
6月4日,国家药监局(NMPA)官网显示,康方生物自主研发的 PD-1/CTLA-4 双特异性抗体卡度尼利单抗注射液(商品名:开坦尼)的新适应症上市申请已获得批准(受理号:CXSS2400042)。
此次获批的适应症为卡度尼利单抗加含铂化疗联合/不联合贝伐珠单抗用于一线治疗持续、复发或转移性宫颈癌。

截图来源:NMPA官网
卡度尼利单抗是康方生物自主研发的一款 PD-1/CTLA-4 靶向人源化 IgG1 四聚体双特异性抗体药物。自2017年8月首次公示启动临床以来,历经多年的研发与临床试验,终于在肿瘤免疫治疗领域崭露头角。2022年6月,卡度尼利单抗首次获批上市,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗,填补了中国晚期宫颈癌免疫治疗的空白。
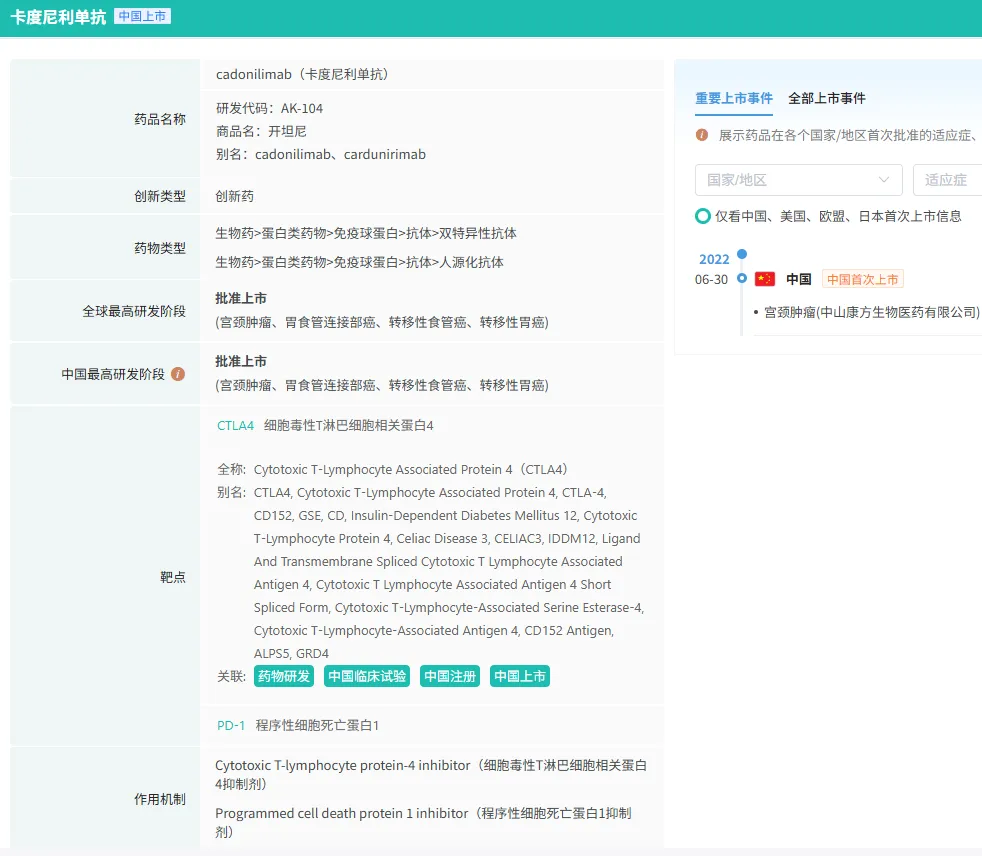
截图来源:yl23455永利官网竞争情报数据库
2024年9月,该药再次获批,联合奥沙利铂和卡培他滨(XELOX)一线治疗不可手术切除的局部晚期复发或转移性胃或胃食管结合部(G/GEJ)腺癌。本次是卡度尼利的第3项获批适应症,不仅进一步深化了该药在宫颈癌领域的布局,更将其适用范围拓展至一线治疗。
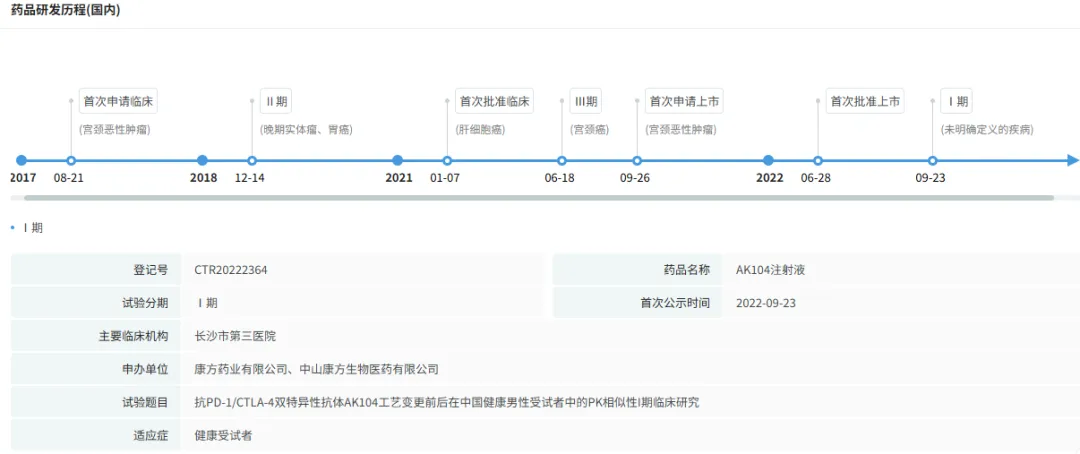
截图来源:yl23455永利官网竞争情报数据库
此次卡度尼利方案一线治疗晚期宫颈癌的新适应症获批是基于 COMPASSION-16/AK104-303 研究。该项研究的 PFS 和 OS 双阳性结果,在2024年10月作为 Late-Breaking Abstract(LBA)发表于2024年国际妇科癌症学会全球会议(IGCS 2024),并同期登陆柳叶刀主刊。

COMPASSION-16 研究的主要研究终点为独立中心影像评估(BICR)基于 RECIST v1.1 评估的无进展生存期(PFS)和总生存期(OS)。COMPASSION-16 研究共入组445例患者,卡度尼利联合化疗±贝伐珠单抗治疗组 CPS<1 人群占比27.9%,对照组占比24.2%。
具体而言,ITT人群中,卡度尼利方案中位 OS 尚未达到,对照组为 22.8 个月(HR 0.64,P=0.0011),12个月 OS 率分别为 83.1% 和 73.7%,24个月 OS 率分别为 62.6% 和 48.4%。ITT人群中,卡度尼利方案的中位 PFS 为12.7个月,对照组为 8.1 个月(HR 0.62,P<0.0001)。12个月 PFS 率分别为 51.1% 和 35%。
卡度尼利方案抗肿瘤治疗缓解高效且疗效持久,卡度尼利方案组的客观缓解率(ORR)为 82.9%,对照组为 68.6%,其中完全缓解(CR)率分别为 35.6% 和 22.9%。中位持续缓解时间(DOR)分别为 13.2 个月和 8.2 个月。
结果显示,卡度尼利方案,无论是否联合贝伐珠单抗一线治疗持续、复发或转移性宫颈癌均具有优异的临床疗效,填补了不适合使用贝伐珠单抗的宫颈癌患者治疗的临床空白。同时,卡度尼利方案对于全人群患者(无论 PD-L1 阳性表达或阴性表达人群)均有显著获益。COMPASSION-16 研究展现了卡度尼利方案完全迭代晚期宫颈癌标准治疗的巨大临床价值和商业化潜力。
据yl23455永利官网数据库显示,卡度尼利单抗自获批后销量急速上涨,2023年度该药销全国医院销售额达1.65 亿元,2024年为2.53 亿元,同比增长53.52%。随着适应症的不断拓展,卡度尼利的市场规模也将不断释放。





























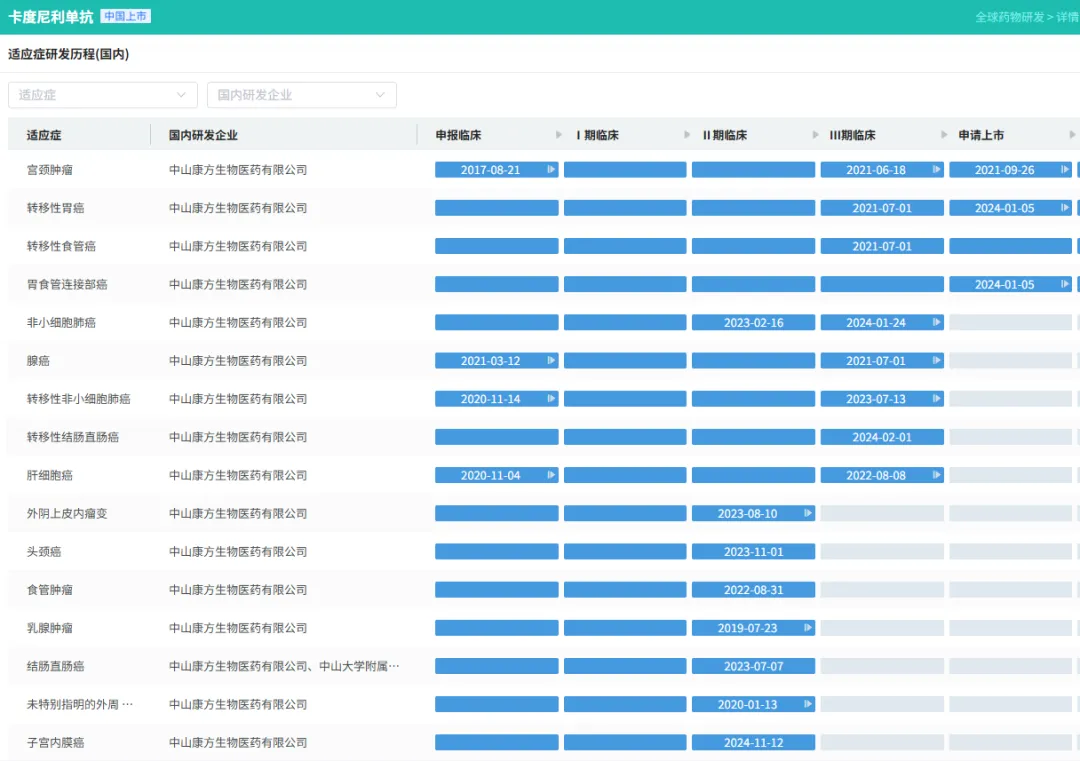













 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论