1.4.1 本周全球TOP10创新药研发进展
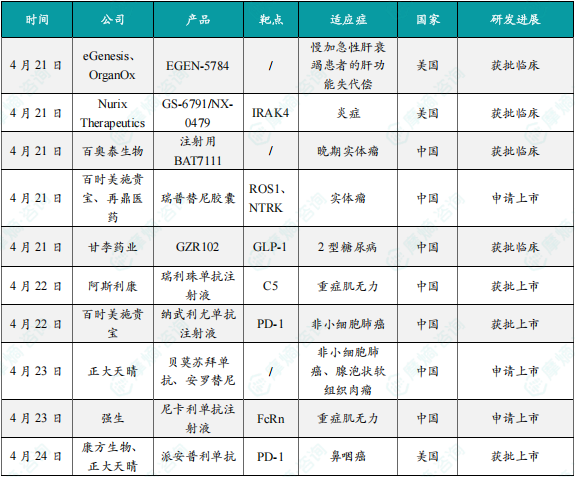
(1)eGenesis和OrganOx共同开发的EGEN-5784在美国获批临床
4月21日,eGenesis和OrganOx公司宣布,美国FDA已批准EGEN-5784的IND申请。EGEN-5784是一种适用于人体的基因工程改造猪肝脏,与OrganOx的体外肝脏交叉循环(ELC)系统联用,用于治疗重症监护环境中慢加急性肝衰竭(acute-on-chronic liver failure,ACLF)患者的肝功能失代偿。2024年11月,OrganOx与eGenesis签署了一项独家临床共同开发协议,以推进这一潜在的救命技术,该技术面向因急性或慢加急性肝衰竭住院的患者,他们现有治疗选择有限,且短期死亡率高达50%。eGenesis的基因工程改造猪肝联合OrganOx的ELC系统,可以支持患者的肝脏功能,促使患者原生肝脏的恢复,或为患者争取足够时间接受肝脏移植。这项1期试验将招募多达20例不适合移植的ACLF及肝性脑病(≤3级)患者。
(2)Nurix Therapeutics在研药物GS-6791/NX-0479在美国获批临床
4月21日,Nurix Therapeutics公司宣布,美国FDA已批准其IRAK4降解剂GS-6791/NX-0479的IND申请。GS-6791是一种强效、选择性、口服IRAK4降解剂,靶向IRAK4蛋白激酶的支架和激酶功能,能够阻断toll样受体(TLR)和促炎性IL1细胞因子受体家族(IL1Rs)下游的炎症反应。GS-6791降解IRAK4在治疗类风湿关节炎(RA)和其他炎症性疾病的治疗中具有潜在的应用价值。Nurix公司的合作伙伴吉利德科学(Gilead Sciences)于2023年获得了该项目的独家授权,并负责其临床开发。
(3)百奥泰1类新药注射用BAT7111在中国获批临床
4月21日,中国国家药监局药品审评中心(CDE)官网公示,百奥泰生物1类新药注射用BAT7111获得临床试验默示许可,拟开发治疗晚期实体瘤。根据百奥泰生物公告可知,BAT7111是其开发的PD-1/4-1BB双特异抗体,本次是该产品首次在中国获批IND。BAT7111由重组人源化抗PD-1抗体和全人源4-1BB单域抗体组成,既可以阻断PD-1/PD-L1免疫抑制通路,又可以通过4-1BB激活免疫细胞,从而达到解除免疫抑制和激活免疫抗肿瘤的协同效应。
(4)百时美施贵宝与再鼎医药在研药物瑞普替尼胶囊新适应症申报上市
4月21日,中国国家药监局药品审评中心(CDE)官网公示,由百时美施贵宝公司申报的瑞普替尼胶囊新适应症上市申请已获得受理。瑞普替尼(repotrectinib)是靶向作用于ROS1及NTRK致癌驱动基因的新一代酪氨酸激酶抑制剂(TKI),再鼎医药拥有该产品在大中华区的独家开发及商业化权。该药本次申报上市的适应症为:用于治疗携带神经营养酪氨酸受体激酶(NTRK)基因融合的实体瘤成人患者,该类患者为局部晚期、转移性,或手术切除可能导致严重并发症的患者,且这些患者在接受既往治疗后出现疾病进展,或缺乏有效的治疗方案选择。针对该项适应症,瑞普替尼此前已经被CDE正式纳入优先审评。而针对既往接受过TRK TKI治疗失败的NTRK融合阳性的晚期实体瘤,瑞普替尼还已经被CDE纳入突破性治疗品种。
(5)甘李药业1类新药GZR102在中国获批临床
4月21日,中国国家药监局药品审评中心(CDE)官网公示,甘李药业1类新药GZR102在中国获得临床试验默示许可,拟开发治疗2型糖尿病。根据甘李药业公告,GZR102注射液是其自主研发的基础胰岛素与胰高糖素样肽-1受体激动剂(GLP-1 RA)的固定比例复方周制剂,由在研超长效胰岛素GZR4注射液和超长效GLP-1 RA博凡格鲁肽(GZR18)注射液以固定比例组成,本次是该产品首次在中国获批临床。与单组分相比,GZR102有望更好地降低糖化血红蛋白(HbA1c),与基础胰岛素相比具有更好的体重控制优势,并有望减少低血糖风险。同时,目前已上市的基础胰岛素/GLP-1RA固定比例复方制剂为日制剂,患者需每日注射。GZR102注射液预期可以在达到良好安全性与有效性的同时,减少注射频率,进一步改善患者的用药依从性,提高 2 型糖尿病患者的生活质量。
(6)阿斯利康的重症肌无力抗体新药瑞利珠单抗注射液在中国获批上市
4月22日,阿斯利康(AstraZeneca)宣布瑞利珠单抗注射液(ravulizumab)的上市申请已获得中国国家药监局(NMPA)批准,与常规治疗药物联合用于治疗抗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)患者。瑞利珠单抗是一款长效补体C5蛋白抑制剂。通过每八周一次的给药方式,可改善患者的生活质量,帮助减轻治疗负担。瑞利珠单抗最早于2018年获得美国FDA批准上市,用于治疗阵发性睡眠性血红蛋白尿症(PNH),患者只需要每8周接受一次注射就可以有效控制溶血的发生。此后,该药相继获FDA批准治疗多种自身免疫性疾病,包括非典型溶血性尿毒症综合征、重症肌无力、视神经脊髓炎谱系疾病(NMOSD)等。
(7)百时美施贵宝的纳武利尤单抗注射液在中国获批新适应症
4月22日,百时美施贵宝宣布,PD-1抑制剂欧狄沃(纳武利尤单抗注射液)获得中国NMPA批准新增适应症:联合含铂化疗作为新辅助治疗,术后继续以欧狄沃作为单药辅助治疗,用于治疗可手术切除的II、 IIIA和IIIB期且无已知表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)重排的成人非小细胞肺癌(NSCLC) 患者。据公开资料,该获批基于CheckMate-77T研究,这是继CheckMate-816后,又一项证实纳武利尤单抗方案用于可切除非小细胞肺癌可带来显著获益的3期研究。此次获批也意味着,纳武利尤单抗成为在中国获批两项可切除NSCLC适应症的免疫治疗药物,覆盖围术期与单纯新辅助治疗,为接受过纳武利尤单抗新辅助治疗方案及手术切除的患者提供了更丰富的后续治疗选择。
(8)正大天晴的贝莫苏拜单抗和安罗替尼多项新适应症在中国申报上市
4月23日,中国国家药监局药品审评中心(CDE)官网公示,正大天晴申报的贝莫苏拜单抗注射液和盐酸安罗替尼胶囊的多项新适应症上市申请获得受理。莫苏拜单抗是一款创新人源化抗PD-L1单克隆抗体,盐酸安罗替尼胶囊是一款口服新型小分子多靶点酪氨酸激酶抑制剂。贝莫苏拜单抗与安罗替尼联合疗法于2024年5月在中国获批,用于一线治疗广泛期小细胞肺癌(ES-SCLC)患者。根据正大天晴公开资料,这项联合疗法已经在多项适应症中取得积极临床研究结果,处于上市申报阶段,包括:贝莫苏拜单抗注射液联合或不联合盐酸安罗替尼胶囊用于巩固治疗同步/序贯放化疗后未进展的、局部晚期/不可切除(Ⅲ期)的非小细胞肺癌患者;贝莫苏拜单抗联合化疗后序贯联合盐酸安罗替尼胶囊一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC);贝莫苏拜单抗注射液联合盐酸安罗替尼胶囊治疗晚期或不可切除腺泡状软组织肉瘤(该项适应症已经被CDE正式纳入优先审评)。
(9)强生公司1类新药尼卡利单抗注射液在中国申报上市,针对重症肌无力
4月23日,中国国家药监局药品审评中心(CDE)官网公示,强生公司(Johnson & Johnson)申报的1类新药尼卡利单抗注射液的上市申请已获得受理。尼卡利单抗(nipocalimab)是一款靶向新生儿Fc受体(FcRn)的抗体疗法,该产品通过与FcRn结合,让被单核细胞和内皮细胞摄入的自身抗体不会重新释放到血液中,而是在细胞内被降解。已有研究显示,它可以将血液循环中包括致病自身抗体在内的IgG水平降低超过75%。致病性IgG被认为是自身抗体疾病的根本原因之一。该产品已向美国FDA申报上市,用于治疗全身性重症肌无力(gMG),PDUFA日期为4月29日。值得一提的是,这款疗法还于今年年初被行业媒体Evaluate列为今年有望上市的10大潜在重磅疗法之一。 在中国,该产品已经于去年10月被CDE正式纳入优先审评,适用于治疗自身抗体阳性(抗乙酰胆碱受体[AChR]阳性、抗肌肉特异性酪氨酸激酶[MuSK]阳性或抗低密度脂蛋白受体4 [LRP4]阳性)的全身型重症肌无力(gMG)成人患者和青少年患者(大于12岁)。
(10)康方生物与正大天晴在研药物派安普利单抗获美国FDA批准,针对鼻咽癌
4月24日,美国FDA宣布批准penpulimab-kcqx(派安普利单抗)两项适应症,分别为:联合顺铂或卡铂和吉西他滨用于复发或转移性非角化性鼻咽癌(NPC)成人患者的一线治疗;单药治疗成人转移性非角化性鼻咽癌,这些患者在铂基化疗和至少一种其他先前治疗后或之后出现疾病进展。派安普利单抗为一款采用IgG1亚型并进行Fc段改造的新型差异化抗PD-1单抗,能够更有效增强免疫治疗疗效,且减少不良反应。该产品由康方生物自主研发,并由康方生物与正大天晴合资的正大天晴康方负责后续开发和商业化。
此前,派安普利单抗已在中国获批4项适应症,分别为联合化疗一线治疗局部晚期或转移鳞状非小细胞肺癌,至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤,以及接受过二线及以上系统治疗失败的复发/转移性鼻咽癌、联合化疗一线治疗复发或转移鼻咽癌(NPC)。
1.4.2 本周全球TOP10积极/失败临床结果
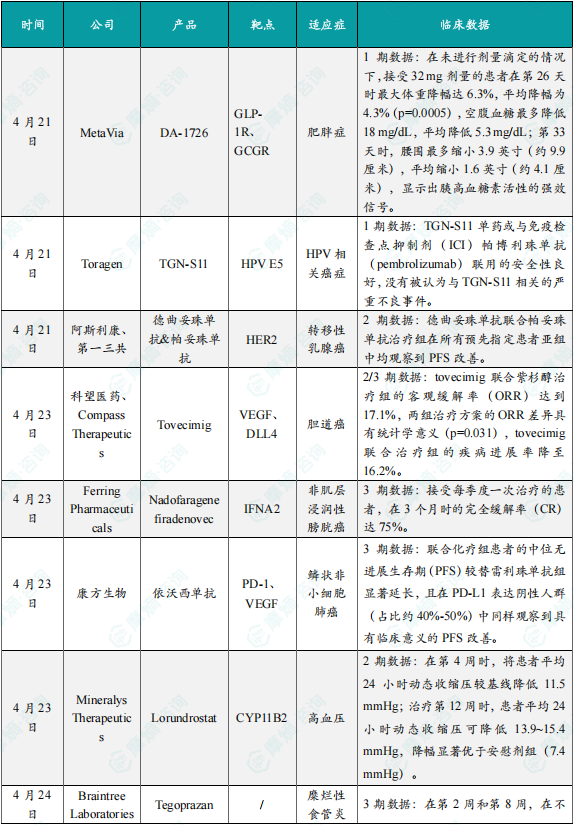
(1)MetaVia公司在研药物DA-1726 1期临床结果积极
4月21日,MetaVia公司宣布其在研疗法DA-1726的1期临床试验取得了积极结果。DA-1726是一种新型胃泌酸调节素(oxyntomodulin,OXM)类似物,具有GLP-1R和GCGR双激动剂的功能,可通过降低食欲和增加能量消耗来减轻体重。DA-1726被设计为每周皮下注射一次,拟开发用于治疗肥胖和代谢功能障碍相关脂肪性肝炎(MASH)。此次公布的结果显示,在未进行剂量滴定的情况下,接受32 mg剂量的患者在第26天时最大体重降幅达6.3%,平均降幅为4.3%(p=0.0005),空腹血糖最多降低18 mg/dL,平均降低5.3 mg/dL;第33天时,腰围最多缩小3.9英寸(约9.9厘米),平均缩小1.6英寸(约4.1厘米),显示出胰高血糖素活性的强效信号。目前该公司正在追加试验组以确定最大耐受剂量。
(2)Toragen公司公布TGN-S11 1期临床试验结果,针对HPV相关癌症
4月21日,Toragen公司公布了其人乳头瘤病毒(HPV)E5癌基因蛋白小分子抑制剂TGN-S11在HPV相关癌症患者中的1期临床试验数据。研究结果显示,TGN-S11单药或与免疫检查点抑制剂(ICI)帕博利珠单抗(pembrolizumab)联用的安全性良好,没有被认为与TGN-S11相关的严重不良事件。此外,53%接受至少2个月治疗的患者表现出药物活性。基于该结果,公司将推动其第二代E5癌基因蛋白抑制剂TGN-S15进入临床,该候选疗法在临床前研究中显示出更高的疗效以及更少的副作用。
(3)阿斯利康与第一三共Enhertu联合疗法在3期DESTINY-Breast09研究中成功
4月21日,阿斯利康宣布其和第一三共合作开发的Enhertu(德曲妥珠单抗)与帕妥珠单抗联合治疗方案在III期DESTINY-Breast09研究中,相较于当前一线标准治疗方案(紫杉烷+曲妥珠单抗+帕妥珠单抗,THP),显著改善了HER2阳性转移性乳腺癌患者的无进展生存期(PFS),具有统计学意义和临床意义。DESTINY-Breast09研究结果显示,Enhertu联合帕妥珠单抗治疗组在所有预先指定患者亚组中均观察到PFS改善。关键次要终点总生存期(OS)在计划进行中期分析时尚不成熟,但与THP治疗组相比,Enhertu联合治疗组的中期OS数据显示出更有利的早期趋势。Enhertu是一种专门设计的靶向HER2的DXd抗体药物偶联物(ADC),由第一三共发现,并由阿斯利康和第一三共联合开发和商业化。
(4)科望医药与Compass Therapeutics在研药物tovecimig 2/3期临床试验达主要终点
4月23日,科望医药与Compass Therapeutics公司宣布,VEGF/DLL4双抗tovecimig(CTX-009/ES104)用于二线胆道癌治疗的2/3期临床试验达到主要终点。Tovecimig是一种在研双特异性抗体,旨在同时阻断DLL4和VEGF-A信号通路,这两种通路对血管生成和肿瘤血管化至关重要。本次公布的该项2/3期临床研究共招募168名胆道癌患者,并按照2:1的比例分别接受tovecimig联合紫杉醇(n=111)或单独紫杉醇(n=57)治疗。数据显示:tovecimig联合紫杉醇治疗组的客观缓解率(ORR)达到17.1%,其中包含1例完全缓解(CR);而单用紫杉醇组的ORR为5.3%。两组治疗方案的ORR差异具有统计学意义(p=0.031),该指标是研究的主要终点,并且所有缓解均已通过盲法独立中心影像学评估确认。tovecimig联合治疗组的疾病进展率降至16.2%,而对照组高达42.1%,显示tovecimig联合治疗可有效控制病情进展。
安全性方面,tovecimig的耐受性良好,与既往研究结果一致。
(5)Ferring Pharmaceuticals公布nadofaragene firadenovec 3期临床试验结果积极
4月23日,Ferring Pharmaceuticals公布了在日本开展的一项3期临床试验的初步结果,该试验评估了基因疗法nadofaragene firadenovec在高危卡介苗(BCG)无应答的非肌层浸润性膀胱癌(NMIBC)伴原位癌(CIS)患者中的疗效和安全性。数据显示,接受每季度一次治疗的患者,在3个月时的完全缓解率(CR)达75%(15/20)。此外,妙佑医疗国际(Mayo Clinic)最近公布的真实世界数据显示,接受nadofaragene firadenovec治疗的患者CR高达79%,证明了nadofaragene firadenovec在真实临床环境中同样具有持续一致的疗效和安全性。Nadofaragene firadenovec是一种基于非复制型腺病毒载体的基因疗法,每3个月经导管灌注,将携带编码干扰素α-2b的转基因的腺病毒载体递送至膀胱。通过转染膀胱内皮细胞,导致膀胱产生大量的干扰素α-2b蛋白。这种基因疗法可以将患者自身膀胱壁细胞转化为制造干扰素的微型工厂,增强机体抵抗癌症的天然防御能力。
(6)康方生物依沃西单抗3期临床试验结果积极
4月23日,康方生物宣布,其PD-1/VEGF双抗药物依沃西(依达方)联合化疗一线治疗晚期鳞状非小细胞肺癌(sq-NSCLC)的3期研究(HARMONi-6)取得压倒性胜利:相较当前标准疗法(替雷利珠单抗+化疗),依沃西组患者无进展生存期(PFS)显著延长,且全人群(无论PD-L1表达)均获益,这是继EGFR耐药非鳞癌适应症后,依沃西斩获的第3项3期阳性结果。HARMONi-6研究期中分析显示,依沃西联合化疗组患者的中位无进展生存期(PFS)较替雷利珠单抗组显著延长,且在PD-L1表达阴性人群(占比约40%-50%)中同样观察到具有临床意义的PFS改善,彻底打破传统PD-1疗法对生物标志物的依赖。尤为关键的是,研究纳入的63%中央型鳞癌患者(传统抗血管治疗禁忌人群)在依沃西组中PFS获益与整体人群一致。
(7)Mineralys Therapeutics降压药Lorundrostat 2期临床结果公布
4月23日,Mineralys Therapeutics公司宣布,已发表关键性2期临床试验Advance-HTN的详细结果于《新英格兰医学杂志》。该试验旨在评估在研疗法lorundrostat在控制不佳高血压或难治性高血压患者中的效果。试验结果显示,lorundrostat在第4周时,将患者平均24小时动态收缩压较基线降低11.5 mmHg;治疗第12周时,患者平均24小时动态收缩压可降低13.9~15.4 mmHg,降幅显著优于安慰剂组(7.4 mmHg)。新闻稿指出,这一结果展现了lorundrostat解决高血压患者未竟医疗需求的潜力。Lorundrostat是一种口服高度选择性的醛固酮合酶抑制剂。它通过抑制负责醛固酮生成的CYP11B2酶,从而降低醛固酮的水平。体外研究显示,lorundrostat对醛固酮合酶的选择性抑制作用比对皮质醇合酶高374倍,可在不影响皮质醇水平的情况下抑制醛固酮的合成。在高血压受试者中可使血浆醛固酮浓度下降约70%。
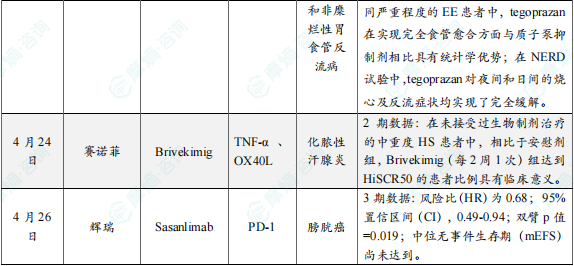
(8)Braintree Laboratories公司小分子药物tegoprazan两项3期临床试验结果积极
4月24日,Sebela Pharmaceuticals旗下Braintree Laboratories宣布,在研钾离子竞争性酸阻断剂(P-CAB)tegoprazan在两项关键性3期临床试验中获得积极顶线结果。在治疗糜烂性食管炎(EE)和非糜烂性胃食管反流病(NERD)的两项关键性研究中,tegoprazan达到所有主要和次要终点。包括在第2周和第8周,在不同严重程度的EE患者中,tegoprazan在实现完全食管愈合方面与质子泵抑制剂相比具有统计学优势。在NERD试验中,tegoprazan对夜间和日间的烧心及反流症状均实现了完全缓解。Tegoprazan是一种在研口服P-CAB药物,用于治疗与酸相关的胃肠道疾病,它具有起效迅速和比质子泵抑制剂更长时间控制胃内pH的能力。
(9)赛诺菲TNF-α/OX40L双抗2期研究成功
4月24日,赛诺菲在公布一季度业绩时透露,Brivekimig(SAR442970)治疗化脓性汗腺炎(HS)的II期研究达到主要终点。Brivekimig是赛诺菲研发的一款TNF-α/OX40L双抗药物,于2023年5月启动针对HS的2期概念验证研究。结果显示,在未接受过生物制剂治疗的中重度HS患者中,相比于安慰剂组,Brivekimig(每2周1次)组达到HiSCR50的患者比例具有临床意义。在其他指标上,Brivekimig组也实现了具有临床意义的改善。此外,在28周治疗期内,Brivekimig的安全性符合预期,未发现新的安全性信号。赛诺菲认为,目前的数据证明Brivekimig是一款有竞争力的药物。
(10)辉瑞公布膀胱癌在研新药Sasanlimab联合疗法3期临床数据
4月26日,辉瑞公司宣布,针对其在研创新药Sasanlimab的关键性III期CREST临床试验达到主要研究终点。Sasanlimab是一款皮下注射PD-1单抗(mAb),该研究旨在评估Sasanlimab联合标准治疗(SOC)卡介苗(BCG)诱导伴或不伴维持治疗,在既往未接受过卡介苗治疗的高危非肌层浸润性膀胱癌(NMIBC)患者中的疗效,试验已达到主要终点,即研究者评估的无事件生存期(EFS)。与单独使用卡介苗(诱导伴维持)治疗相比,Sasanlimab与卡介苗(诱导伴维持)的联合治疗方案显示出具有临床意义且统计学显著的无事件生存期(EFS)改善:风险比(R)为0.68; 95%置信区间(CI),0.49-0.94;双臂p值=0.019;中位无事件生存期(mEFS)尚未达到。研究显示,相比对照组,联合治疗方案可将疾病相关事件(包括高级别疾病复发或进展)风险降低32%。在预设的更高风险患者亚组中,联合治疗组在无事件生存期方面均展现出一致的获益,其中T1期患者的无事件生存期风险比(HR)为0.63 (0.41, 0.96) ,伴有原位癌(CIS)的患者无事件生存期风险比(HR)为0.53 (0.29, 0.98)。
同期事件:
1. 2025年第17周04.21-04.27国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第17周04.21-04.27国内仿制药/生物类似物申报/审批数据分析
3. 2025年第17周04.21-04.27国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.04.21-2025.04.27) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询yl23455永利官网(原药融云)数据库(vip.sdbaichao.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论