
目 录
第一章 药品注册申请受理情况
(一)总体情况
(二)技术审评类药品注册申请受理情况
1. 中药注册申请受理情况
2. 化学药品注册申请受理情况
3. 生物制品注册申请受理情况
(三)直接行政审批类注册申请受理情况
第二章 药品注册申请审评审评情况
(一)总体情况
(二)技术审评类注册申请审结情况
1. 中药注册申请审结情况
2. 化学药品注册申请审结情况
3. 生物制品注册申请审结情况
(三)直接行政审批类注册申请审结情况
第三章 药品加快上市注册情况
(一)突破性治疗药物程序
(二)附条件批准程序
(三)优先审评审批程序
第四章 药品研发与审评沟通交流
(一)沟通交流会议申请与办理情况
(二)一般性技术问题咨询情况
第五章 完善药品技术指导原则体系
(一)制定发布药品技术指导原则
(二)推动 ICH 指导原则转化实施
第六章 药品监管科学研究
(一)研究项目
(二)合作与沟通
(三)研究成果与转化
第七章 药品研发与技术审评宣贯与培训
第八章 2024年度药品审评主要工作回顾
附件 4 2024 年国家药监局批准的境外已上市境内未上市的药品
附件 5 2024 年国家药监局批准的药品纳入加快上市程序情况
附件 8 2024 年药审中心发布的指导原则
附件 9 2024 年药审中心开展的培训
第一章 药品注册申请受理情况
(一)总体情况
2024 年,药品注册申请申报量持续增长,药审中心受理各类注册申请 19563 件(同比增加 5.73%,以受理号计,下同),包括药品制剂注册申请 17476 件(同比增加 3.42%),化学原料药注册申请 2087 件(同比增加 30.03%)。17476 件药品制剂注册申请包括技术审评类注册申请 15318 件(同比增加 16.46%),直接行政审批类注册申请 2158件(包括补充申请和一次性进口)。2020 年至 2024 年注册申请受理情况详见图1。
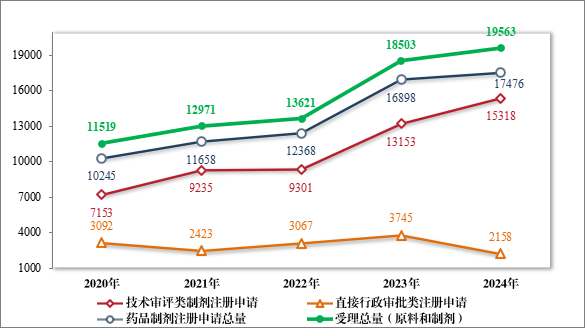
图 1 2020 年至 2024 年注册申请受理情况(件)
(二)技术审评类药品注册申请受理情况
2024 年受理的 15318 件技术审评类药品注册申请中,以药品类型统计,中药注册申请 2407 件,化学药品注册申请 10464 件,生物制品注册申请 2447 件。2020 年至 2024 年需技术审评的各药品类型注册申请受理情况详见图2。
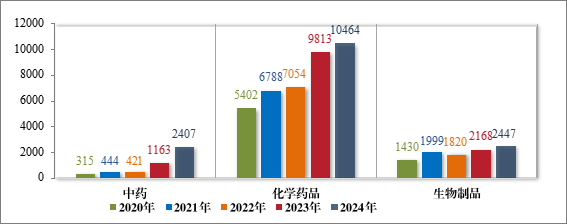
图 2 2020 年至 2024 年需技术审评的各药品类型注册申请受理情况(件)
以注册申请类别统计,受理新药临床试验申请(该注册申请类别以下简称“IND”)3073 件,验证性临床试验申请 247 件,新药上市许可申请(该注册申请类别以下简称“NDA”)549 件,同名同方药、化学仿制药上市许可申请(该注册申请类别以下简称“ANDA”)4770 件,仿制药质量和疗效一致性评价注册申请(该注册申请类别以下简称 “一致性评价申请”)659 件,补充申请 5600 件,境外生产药品再注册申请 420 件。2020 年至 2024 年需技术审评的各类别注册申请受理情况详见图 3。
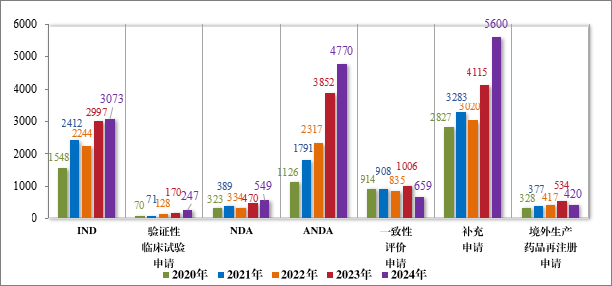
图 3 2020 年至 2024 年需技术审评的各类别注册申请受理情况(件)
1. 中药注册申请受理情况
2024 年受理中药注册申请 2407 件,按注册申请类别统计,IND100 件,NDA 40 件,补充申请 2262 件,ANDA 2 件,境外生产药品再注册申请 3 件。2020 年至 2024 年需技术审评的中药各类别注册申请受理情况详见图 4。
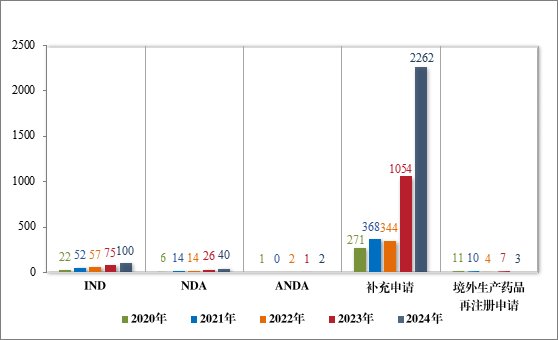
图 4 2020 年至 2024 年需技术审评的中药各类别注册申请受理情况(件)
以注册分类统计,100 件 IND 中,包括创新中药 IND 80 件(71个品种),改良型中药 IND 19 件(16 个品种),同名同方药 IND 1 件(1 个品种);40 件 NDA 中,包括创新中药 NDA 11 件(11 个品种),改良型中药 NDA 1 件(1 个品种),古代经典名方中药复方制剂 NDA 28 件(17 个品种)。
2024 年各注册分类中药 IND、NDA 受理情况详见表 1,2020 年至 2024 年各注册分类中药 IND 受理情况详见图 5,2020 年至 2024年各注册分类中药 NDA 受理情况详见图 6。
表 1 2024 年各注册分类中药 IND、NDA 受理情况
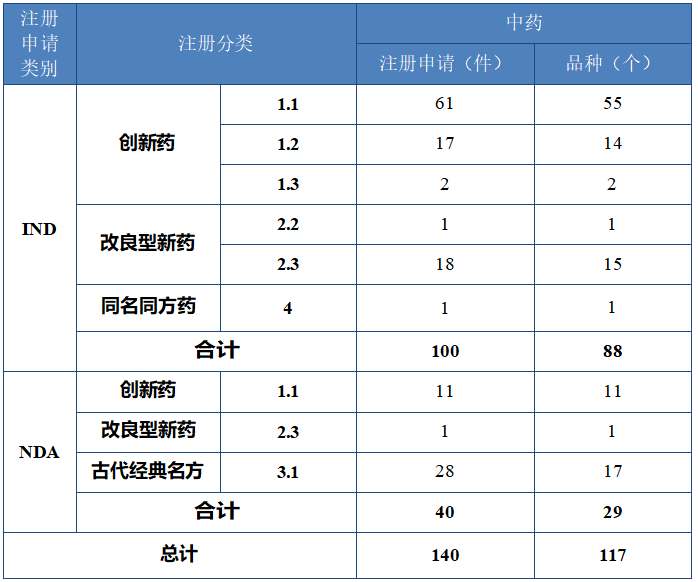
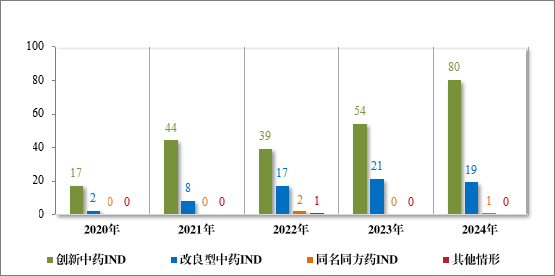
图 5 2020 年至 2024 年各注册分类中药 IND 受理情况(件)
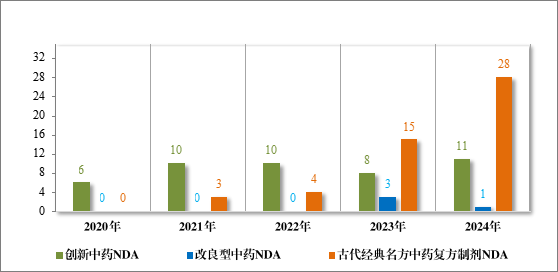
图 6 2020 年至 2024 年各注册分类中药 NDA 受理情况(件)
2. 化学药品注册申请受理情况
2024 年受理需技术审评的化学药品注册申请 10464 件,按注册申请类别统计,IND 1785 件,验证性临床试验申请 247 件,NDA 255件,ANDA 4768 件,一致性评价申请 659 件,补充申请 2396 件,境外生产药品再注册申请 354 件。2020 年至 2024 年需技术审评的化学药品各类别注册申请受理情况详见图 7。
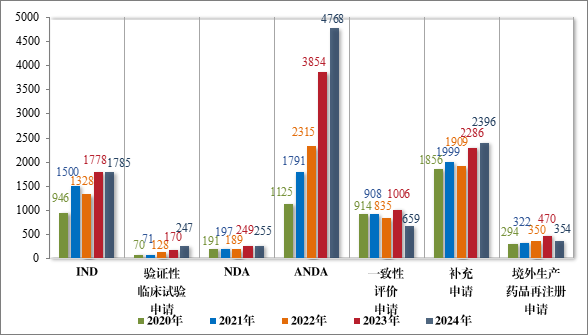
图 7 2020 年至 2024 年需技术审评的化学药品各类别注册申请受理量(件)
以注册分类统计,1785 件 IND 中,包括创新化学药品 IND 1345件(568 个品种),改良型化学药品 IND 440 件(237 个品种);255 件 NDA 中,包括创新化学药品 NDA 57 件(38 个品种),改良型化学药品 NDA 108 件(46 个品种),5.1 类化学药品 NDA 90 件(57 个品种)。
2024 年各注册分类化学药品 IND、NDA 受理情况详见表 2,2020年至 2024 年各注册分类化学药品临床试验申请受理情况详见图 8, 2020 年至 2024 年各注册分类化学药品 NDA 受理情况详见图 9。
表 2 2024 年各注册分类化学药品 IND、NDA 受理情况
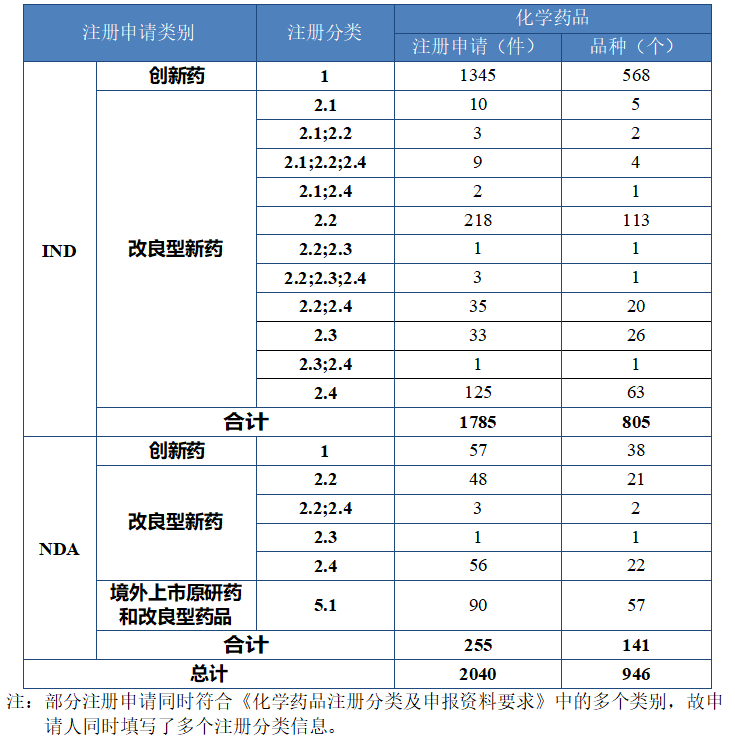
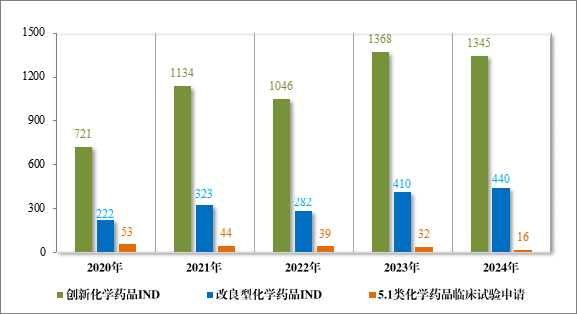
图 8 2020 年至 2024 年各注册分类化学药品临床试验申请受理情况(件)
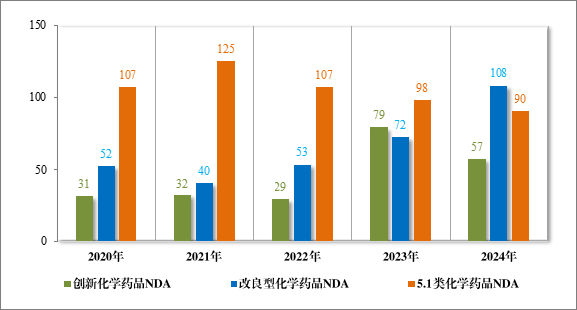
图 9 2020 年至 2024 年各注册分类化学药品 NDA 受理情况(件)
3. 生物制品注册申请受理情况
2024 年受理生物制品注册申请 2447 件,包括预防用生物制品注册申请 239 件、治疗用生物制品注册申请 2201 件和体外诊断试剂 7件。
按注册申请类别统计,IND 1188 件,NDA 254 件,补充申请 942件,境外生产药品再注册申请 63件。2020 年至 2024 年需技术审评的生物制品各类别注册申请受理情况详见图 10。
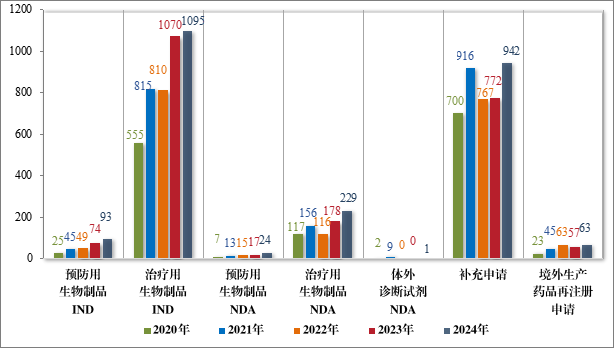
图 10 2020 年至 2024 年需技术审评的生物制品各类别注册申请受理情况(件)
以注册分类统计,预防用生物制品 IND 93 件中,包括创新预防用生物制品 IND 62 件(41 个品种),改良型预防用生物制品 IND 11件(8 个品种),境内或境外已上市预防用生物制品 IND 20 件(16 个品种);预防用生物制品 NDA 24 件中,包括改良型预防用生物制品 NDA 4 件(3 个品种),境内或境外已上市预防用生物制品 NDA 20 件(14 个品种)。
2024 年各注册分类预防用生物制品 IND、NDA 受理情况详见表3,2020 年至 2024 年各注册分类预防用生物制品 IND 受理情况详见图 11,2020 年至 2024 年各注册分类预防用生物制品 NDA 受理情况详见图 12。
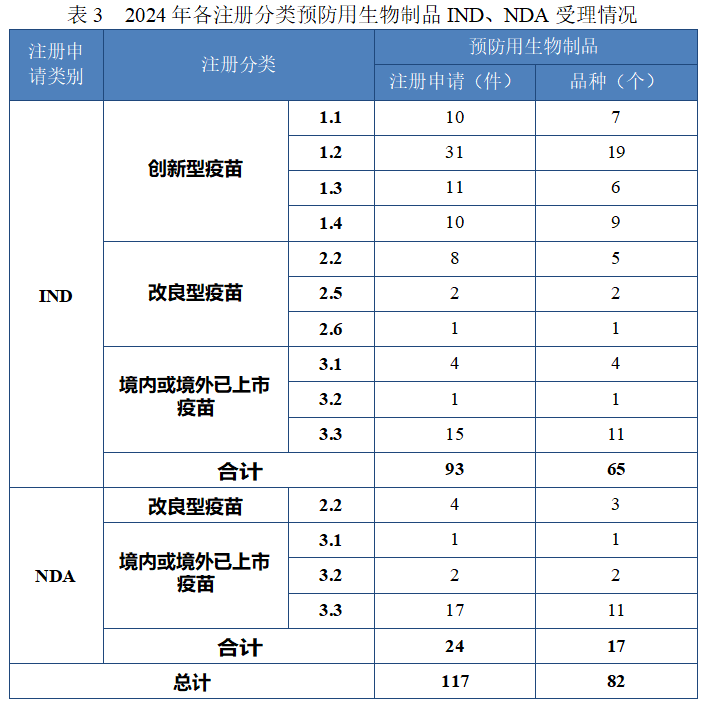
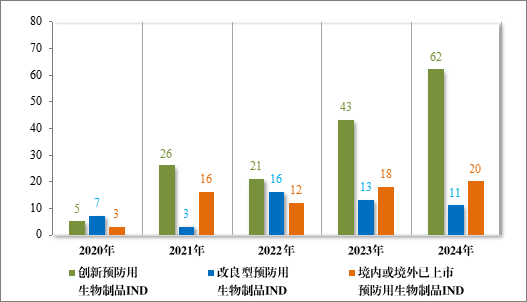
图 11 2020 年至 2024 年各注册分类预防用生物制品 IND 受理情况(件)
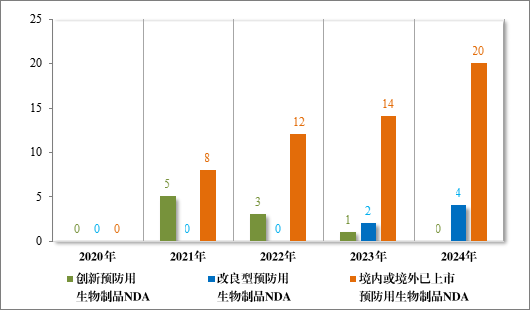
图 12 2020 年至 2024 年各注册分类预防用生物制品 NDA 受理情况(件)
以注册分类统计,治疗用生物制品 IND 1095 件中,包括创新治疗用生物制品 IND 879 件(563 个品种),改良型治疗用生物制品 IND 138 件(65 个品种),境内或境外已上市治疗用生物制品 IND 78 件(43 个品种)。
治疗用生物制品 NDA 229 件中,包括创新治疗用生物制品NDA 49 件(33 个品种),改良型治疗用生物制品 NDA 84 件(42 个品种),境内或境外已上市治疗用生物制品 NDA 96 件(51 个品种)。
2024 年各注册分类治疗用生物制品 IND、NDA 受理情况详见表4,2020 年至 2024 年各注册分类治疗用生物制品 IND 受理情况详见图 13,2020 年至 2024 年各注册分类治疗用生物制品 NDA 受理情况详见图 14。
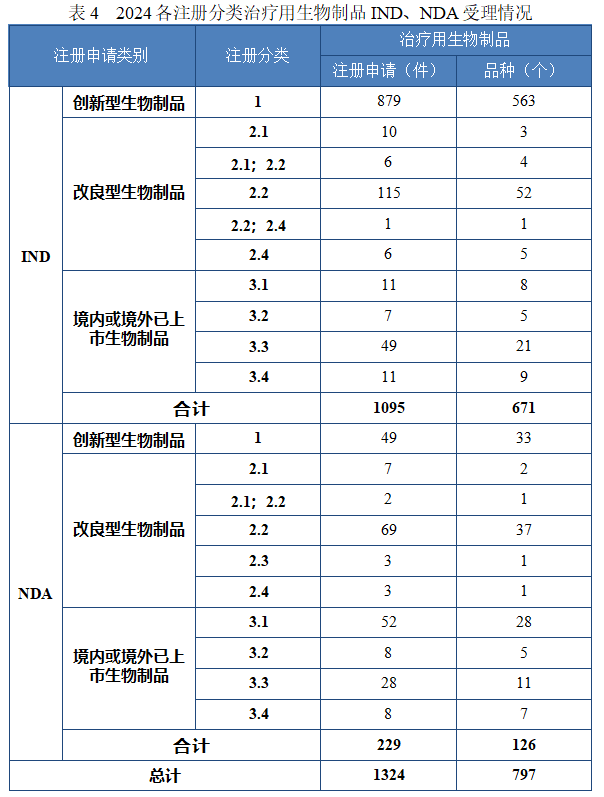
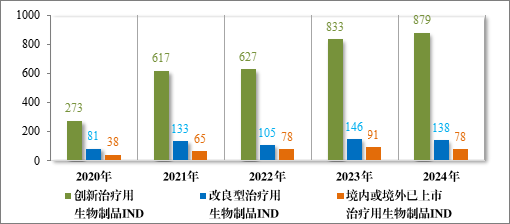
图 13 2020 年至 2024 年各注册分类治疗用生物制品 IND 受理情况(件)
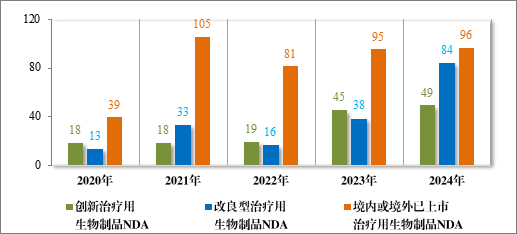
图 14 2020 年至 2024 年各注册分类治疗用生物制品 NDA 受理情况(件)
(三)直接行政审批类注册申请受理情况
2024 年受理直接行政审批类注册申请 2158 件,包括无需技术审评的补充申请 1748 件,临时进口注册申请 410 件。2020 年至 2024 年直接行政审批的各类别注册申请受理情况详见图 15。
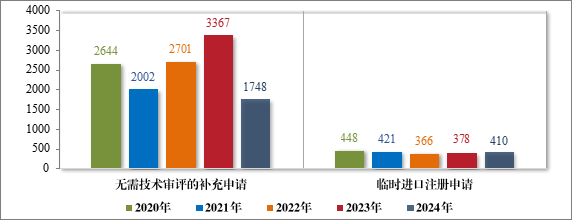
图 15 2020 年至 2024 年直接审批的各类别注册申请受理情况(件)
第二章 药品注册申请审评审评情况
(一)总体情况
2024 年,药审中心审结各类药品注册申请共 18259 件(同比增加 16.20%),包括药品制剂注册申请 16117 件(同比增加 10.98%),化学原料药注册申请 2142 件(同比增加 80.00%)。16117 件药品制剂注册申请包含技术审评类注册申请 13913 件(同比增加 30.74%),直接行政审批类注册申请 2204 件。2020 年至 2024 年药品注册申请审结量详见图 16。
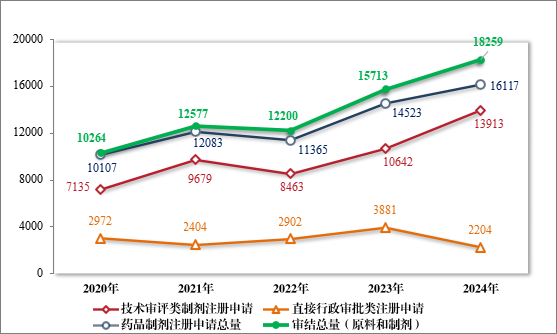
图 16 2020 年至 2024 年注册申请审结量(件)
截至 2024 年底,在审和待审的药品注册申请共 12323 件,其中包含原料药注册申请 2130 件;待申请人回复补充资料的注册申请共2239 件,其中包含原料药注册申请 587 件。
(二)技术审评类注册申请审结情况
2024 年审结的 13913 件技术审评类注册申请中,以药品类型统计,中药注册申请 1907 件,化学药品注册申请 9759 件,生物制品注册申请 2247 件。2020 年至 2024 年需技术审评的各药品类型注册申请审结情况详见图 17。
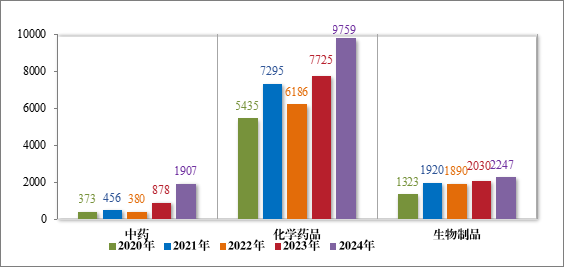
图 17 2020 年至 2024 年需技术审评的各药品类型注册申请审结情况(件)
以注册申请类别统计,2024 年审结 IND 3011 件,验证性临床试验申请 215 件,NDA 439 件,ANDA 3552 件,一致性评价申请 1135件,补充申请 5090 件,境外生产药品再注册申请 471 件。2020 年至2024 年需技术审评的各类别注册申请审结情况详见图 18。
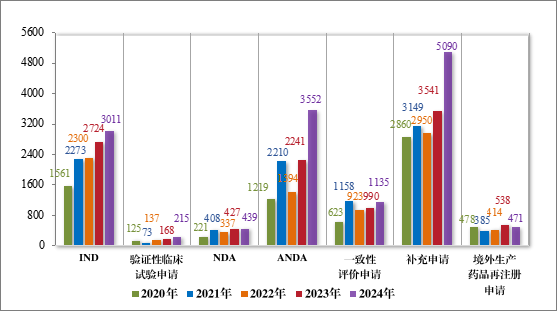
图 18 2020 年至 2024 需技术审评的各类别注册申请审结情况(件)
2024 年,药审中心以临床价值为导向,采取多种措施提高审评效率,加快新药好药上市,为患者提供更多的用药选择。
全年批准上市 1 类创新药 48 个品种1(详见附件 1),其中 17 个品种(35.4%)通过优先审评审批程序批准上市,11 个品种(22.9%)附条件批准上市,13 个品种(27.1%)在临床试验期间纳入了突破性治疗药物程序。
全年批准罕见病用药 55 个品种(未包括化学药品 4 类仿制药),其中 20 个品种(36.4%)通过优先审评审批程序加快上市(详见附件2),2 个品种附条件批准上市。
全年批准儿童用药 106 个品种,包含 71 个上市许可申请,其中20 个品种(18.9%)通过优先审评审批程序加快上市(详见附件 3);另批准 35 个品种扩展儿童适应症。
全年批准境外已上市境内未上市的药品(化学药品 5.1 类、治疗用生物制品 3.1 类和预防用生物制品 3.1 类)89 个品种,其中 64 个为首次批准上市,25 个为已上市药品增加适应症,详见附件 4。
1. 中药注册申请审结情况
2024 年审结中药注册申请 1907 件,按注册申请类别统计,IND75 件,NDA 16 件,补充申请 1808 件,境外生产药品再注册申请 8件。2024 年中药各类别注册申请审结情况详见表 5。
1 年度报告中 1 类创新药、罕见病用药、儿童用药、境外已上市境内未上市的药品以及按照加快上市程序批准的药品,按照国家药监局完成行政审批的时间统计,其余均按照药审中心完成技术审评的时间统计(表述为“建议批准”)。
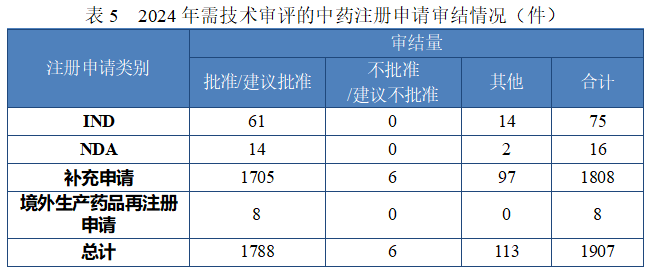
注:“其他”是指申请人未按规定缴纳费用、撤回申请等原因导致审评审批终止的情形。
批准中药 IND 61 件(56 个品种),以注册分类统计,包括创新中药 IND 49 件(44 个品种),改良型中药 IND 11 件(11 个品种),同名同方药 IND 1 件(1 个品种);建议批准的中药 NDA 14 件(14 个品种)中,包括创新中药 NDA 3 件(3 个品种),古代经典名方中药复方制剂NDA 11 件(11 个品种)。
2024 年各注册分类中药 IND、NDA 批准/建议批准情况详见表 6,2020 年至 2024 年各注册分类中药 IND 批准情况详见图 19,2020 年至 2024 年各注册分类中药 NDA、ANDA 建议批准情况详见图 20。
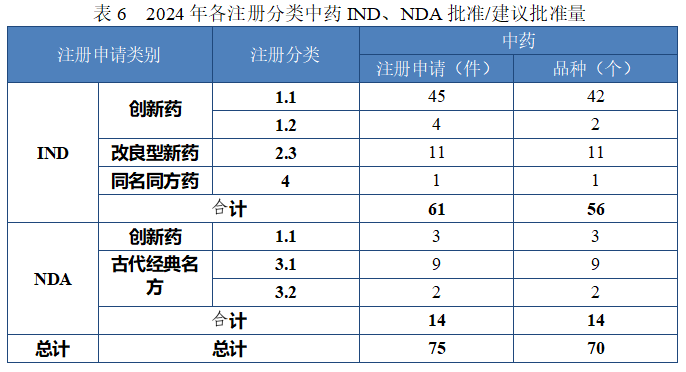
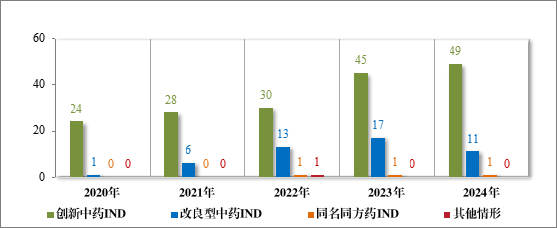
图 19 2020 年至 2024 年各注册分类中药 IND 批准情况(件)
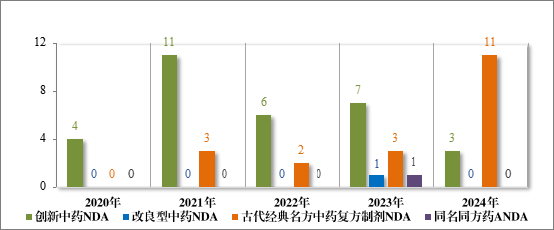
图 20 2020 年至 2024 年各注册分类中药 NDA、ANDA 建议批准情况(件)
批准的 61 件中药 IND 中,涉及 12 个适应症领域,其中呼吸、消化药物较多,占中药 IND 批准量的 39.34%。2024 年批准中药 IND的适应症领域分布情况详见图 21。
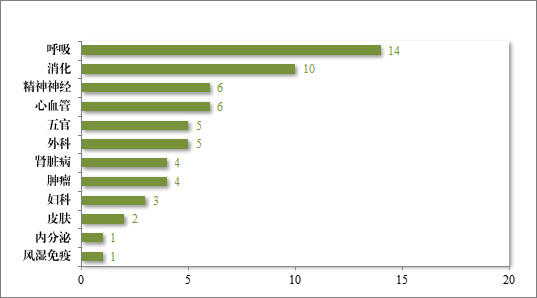
图 21 2024 年批准中药 IND 的适应症领域分布情况(件)
建议批准的中药 NDA 14 件中,涉及 6 个适应症领域,其中呼吸药物较多,占中药 NDA 建议批准量的 28.57%。2024 年建议批准中药 NDA 的适应症领域分布情况详见图 22。
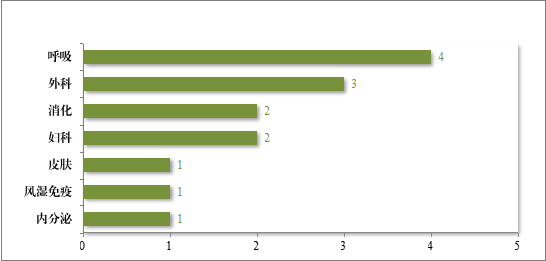
图 22 2024 年建议批准中药 NDA 的适应症领域分布情况(件)
2. 化学药品注册申请审结情况
2024 年审结化学药品注册申请 9759 件,按注册申请类别统计,临床试验申请 1994 件,NDA 230 件,ANDA 3552 件,一致性评价申请 1135 件,补充申请 2449 件,境外生产药品再注册申请 399 件。2024 年化学药品类别注册申请审结情况详见表 7。
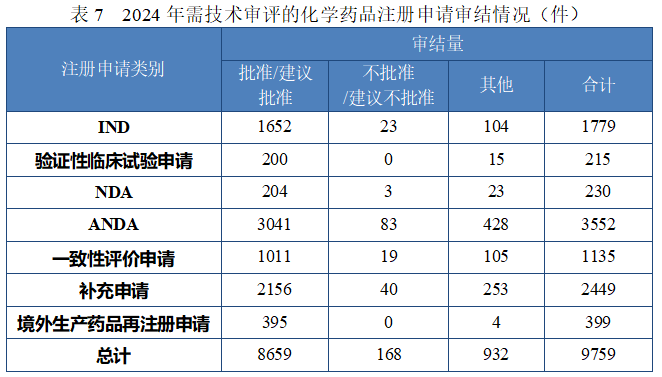
(1) 新药临床试验申请和新药上市申请
批准化学药品 IND 1652 件,以注册分类统计,包括创新化学药品 IND 1247 件(538 个品种),改良型化学药品 IND 405 件(219 个品种);建议批准化学药品 NDA 204 件(123 个品种),以注册分类统计,包括创新化学药品 NDA 41 件(29 个品种),改良型化学药品 NDA 58 件(32 个品种),5.1 类化学药品 NDA 105 件(62 个品种)。
2024 年各注册分类化学药品 IND、NDA 批准/建议批准情况详见表 8,2020 年至 2024 年各注册分类化学药品临床试验申请批准情况详见图 23,2020 年至 2024 年各注册分类化学药品 NDA 建议批准情况详见图 24。
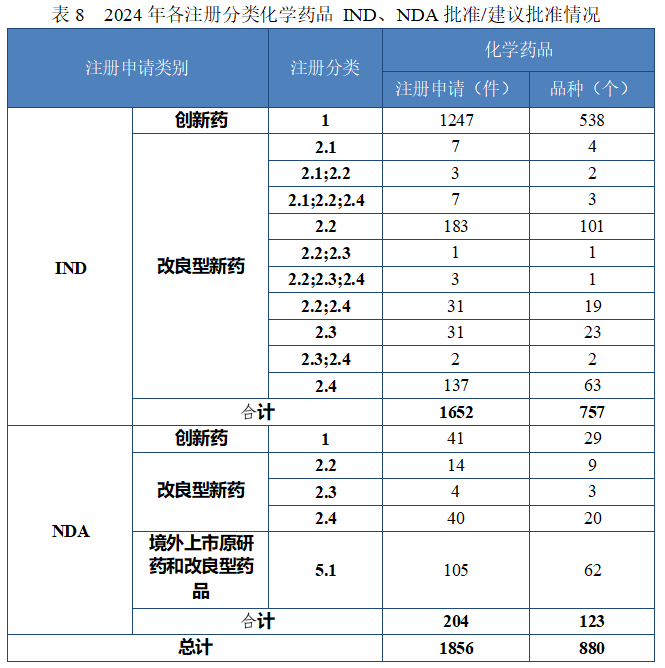
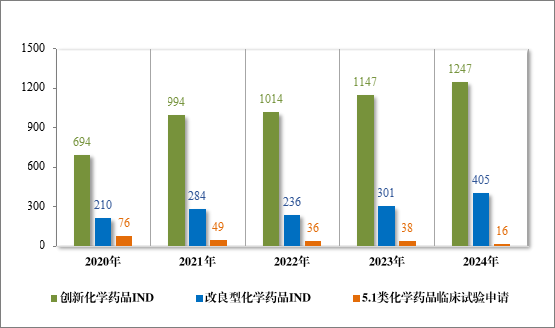
图 23 2020 年至 2024 年各注册分类化学药品 IND 批准情况(件)
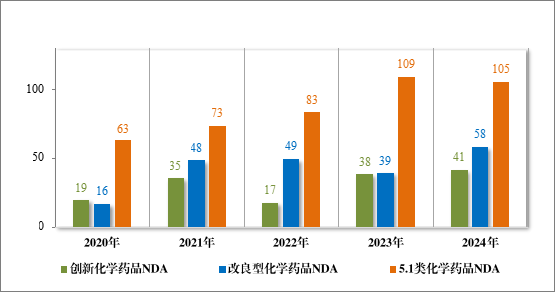
图 24 2020 年至 2024 年各注册分类化学药品 NDA 建议批准情况(件)
批准的化学药品 IND 1652 件中,抗肿瘤药物占 41.89%、皮肤及五官科药物占 11.08%,内分泌系统药物占 6.84%。2024 年批准化学药品 IND 的适应症领域分布情况详见图 25。
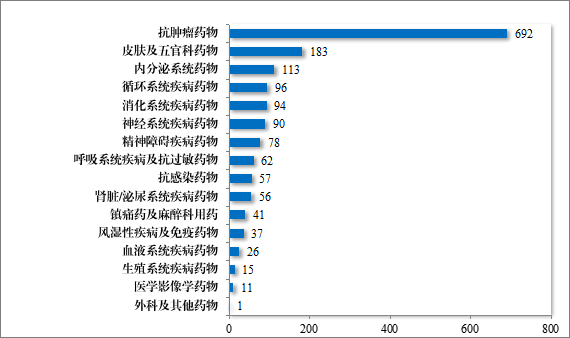
图 25 2024 年批准化学药品 IND 的适应症领域分布情况(件)
建议批准的化学药品 NDA 204 件中,抗肿瘤药物占 36.27%、内分泌系统药物占 10.78%,神经系统疾病药物占 9.31%。2024 年建议批准化学药品 NDA 的适应症领域分布情况详见图 26。
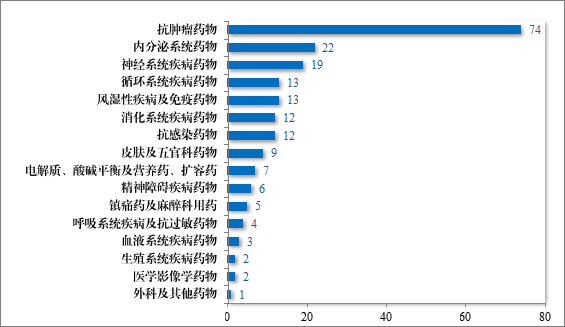
图 26 2024 年建议批准化学药品 NDA 的适应症领域分布情况(件)
(2) 化学仿制药上市申请
2024 年建议批准化学仿制药上市申请3041 件,其中首仿品种289个,有效满足了临床患者对高质量仿制药的需求。
化学药品注册分类改革以来,药审中心按照与原研药品质量和疗效一致性的要求,累计建议批准化学仿制药 7593 件,涉及循环、抗感染、呼吸等 17 个治疗领域,具体见图 27。
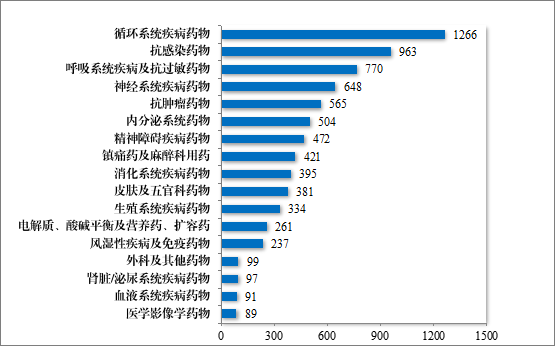
图 27 截至 2024 年建议批准化学药品新注册分类 ANDA 适应症领域分布情况(件)
为落实《国务院办公厅关于进一步做好短缺药品保供稳价工作的意见》,2020 年,国家卫生健康委员会等十二部门联发布了国家短缺药品清单。2024 年,药审中心共建议批准“国家短缺药品清单”内药品 117 件(21 个品种)。近五年累计建议批准短缺药品共 226 件(30个品种),见图 28,涉及循环、电解质、神经、肿瘤和生殖等 12 个治疗领域,具体见图 29,有效保障了短缺药品的供应。
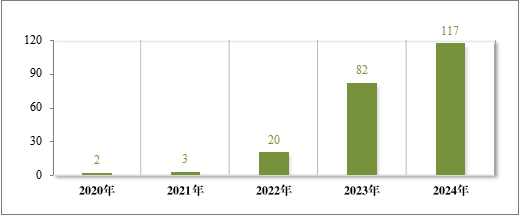
图 28 2020 年至 2024 年“短缺药品清单”内药品建议批准情况
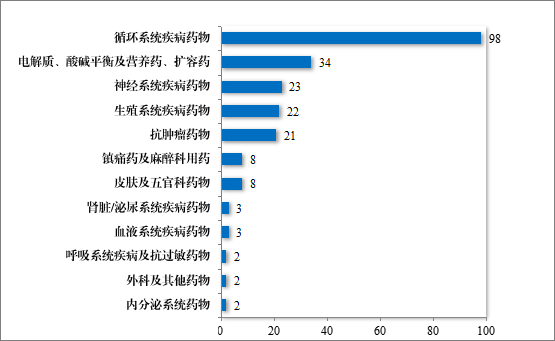
图 29 2020 年至 2024 年建议批准“短缺药品清单”内药品适应症领域分布情况(件)
为进一步促进儿童适宜品种、剂型、规格的研发创制和申报审评,满足儿科临床用药需求,自 2016 年起,国家卫生健康委员会会同有关部门研究制订了五批鼓励研发申报儿童药品清单,共有 160 个品种,包括口服溶液剂、口服混悬剂、颗粒剂等适宜儿童给药剂型。2024年,药审中心建议批准鼓励研发申报儿童药品清单内的儿童用仿制药 17 件(14 个品种)。近五年累计建议批准鼓励研发申报儿童药品清单内的儿童用仿制药 59 件(26 个品种),见图 30,涉及神经、抗肿瘤、内分泌等 8 个治疗领域,具体涉及适应症情况请见图 31。
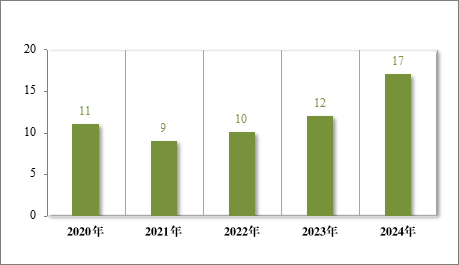
图 30 2020 年至 2024 年“鼓励研发申报儿童药品清单”内药品建议批准情况(件)
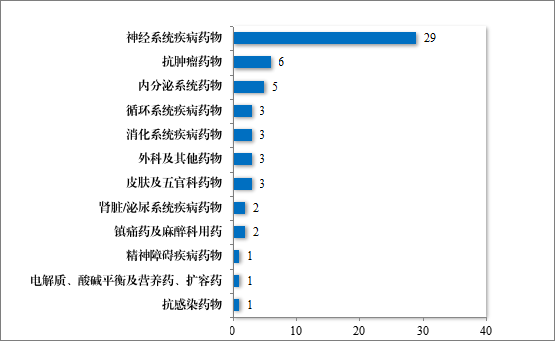
图 31 2020 年至 2024 年建议批准“鼓励研发申报儿童药品清单”内药品适应症领域分布情况(件)
(3) 化学仿制药质量和疗效一致性评价工作
2024 年,药审中心持续推进化学仿制药质量和疗效一致性评价工作,为患者提供高质量仿制药,共发布参比制剂目录 13 批,涉及929 个品规(161 个品种)。截至 2024 年 12 月 31 日,累计发布 87 批参比制剂目录,共 7643 个品规(2677 个品种)。
2024 年批准一致性评价申请 1011 件(354 个品种),其中,口服固体制剂 302 件(180 个品种),注射剂 709 件(174 个品种)。自化学仿制药质量和疗效一致性评价工作开展以来,累计批准一致性评价申请共 4805 件(共计 756 个品种),其中,口服固体制剂 2137 件(计 465 个品种),注射剂 2668 件(计 291 个品种)。2020 年至 2024 年一致性评价申请批准情况详见图 32。
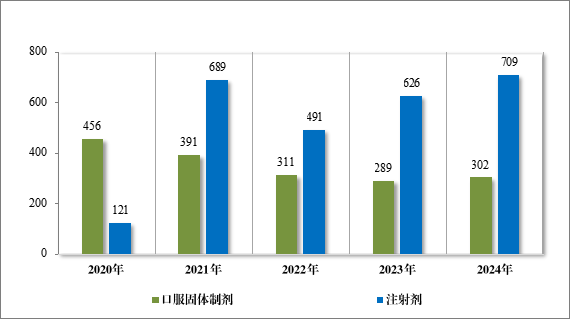
图 32 2020 年至 2024 年一致性评价申请批准量(件)
3. 生物制品注册申请审结情况
2024 年,审结生物制品注册申请 2247 件,包括预防用生物制品184 件,治疗用生物制品 2054 件和体外诊断试剂 9 件。
按注册申请类别统计,IND 1157 件,NDA 193 件,补充申请 833件,境外生产药品再注册申请 64 件。2024 年生物制品类别注册申请审结情况详见表 9。
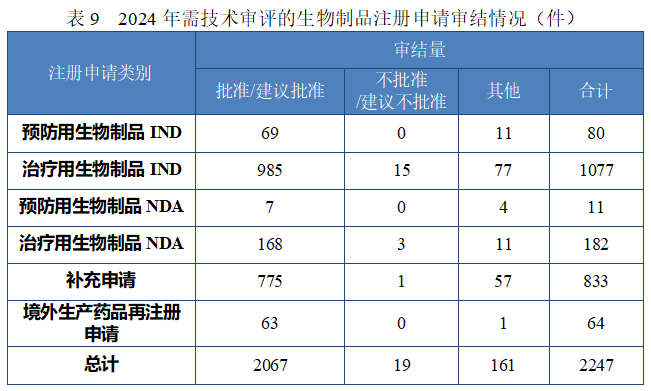
(1) 预防用生物制品
批准预防用生物制品 IND 69 件,以注册分类统计,包括创新预防用生物制品 IND 46 件(33 个品种),改良型预防用生物制品 IND 9件(7 个品种),境内或境外已上市预防用生物制品 IND 14 件(12 个品种);建议批准预防用生物制品 NDA 7 件(3 个品种),以注册分类统计,均为境内或境外已上市预防用生物制品。
2024 年各注册分类预防用生物制品 IND、NDA 批准/建议批准情况详见表 10,2020 年至 2024 年各注册分类预防用生物制品 IND 批准情况详见图 33,2020 年至 2024 年各注册分类预防用生物制品 NDA建议批准情况详见图 34。
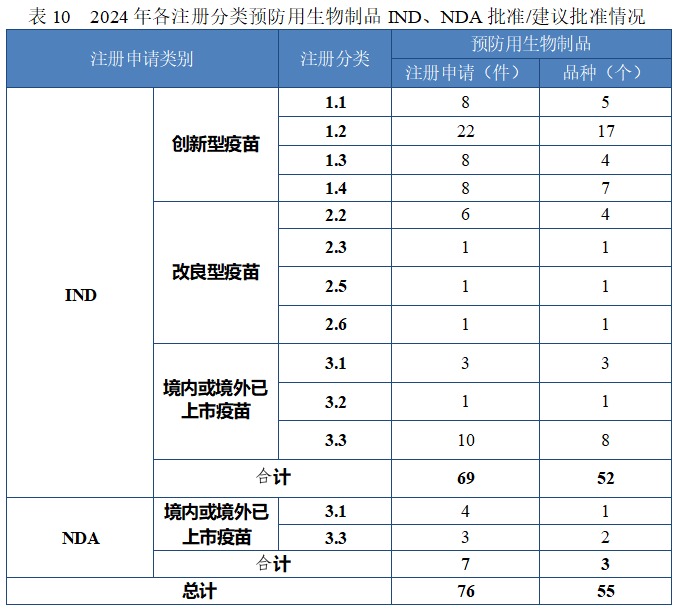
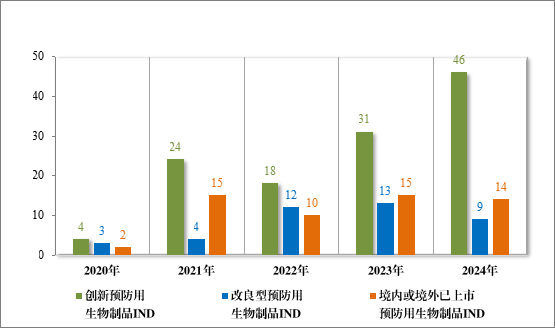
图 33 2020 年至 2024 年各注册分类预防用生物制品 IND 批准情况(件)
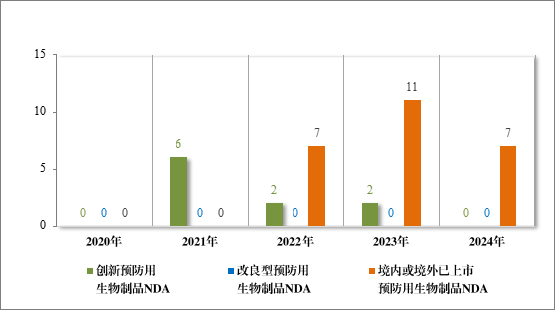
图 34 2020 年至 2024 年各注册分类预防用生物制品 NDA 建议批准情况(件)
(2) 治疗用生物制品
批准治疗用生物制品 IND 985 件,以注册分类统计,包括创新治疗用生物制品 IND 798 件(531 个品种),改良型治疗用生物制品 IND 112 件(57 个品种),境内或境外已上市治疗用生物制品 IND 75 件(36 个品种)。
建议批准治疗用生物制品 NDA 168 件,以注册分类统计,包括创新治疗用生物制品 NDA 34 件(24 个品种),改良型治疗用生物制品 NDA 44 件(23 个品种),境内或境外已上市治疗用生物制品 NDA 90 件(49 个品种),其中包括生物类似药(3.3 类)25 件(15 个品种)。
2024 年各注册分类治疗用生物制品 IND、NDA 批准/建议批准情况详见表 11,2020 年至 2024 年各注册分类治疗用生物制品 IND 批准情况详见图 35,2020 年至 2024 年各注册分类治疗用生物制品 NDA建议批准情况详见图 36。
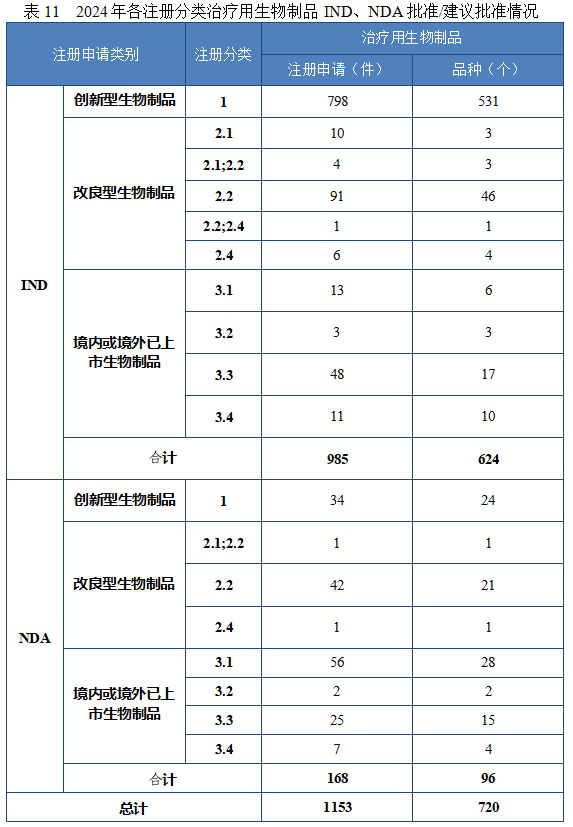
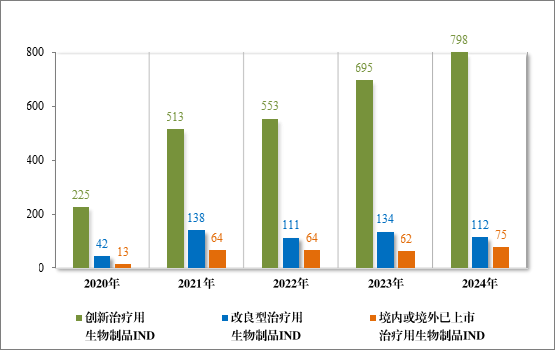
图 35 2020 年至 2024 年各注册分类治疗用生物制品 IND 批准情况(件)
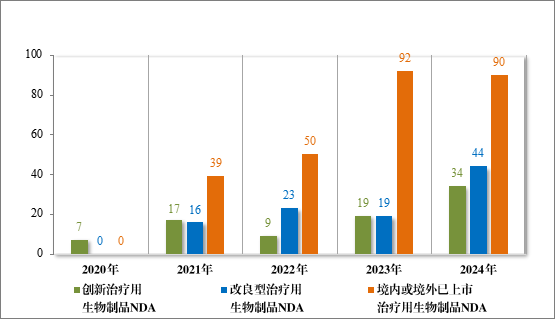
图 36 2020 年至 2024 年各注册分类治疗用生物制品 NDA 建议批准情况(件)
批准的治疗用生物制品 IND 985 件中,抗肿瘤药物占比 55.43%,皮肤及五官科药物占比 10.66%,内分泌系统药物占比 7.31%。2024 年批准治疗用生物制品 IND 的适应症领域分布情况详见图 37。
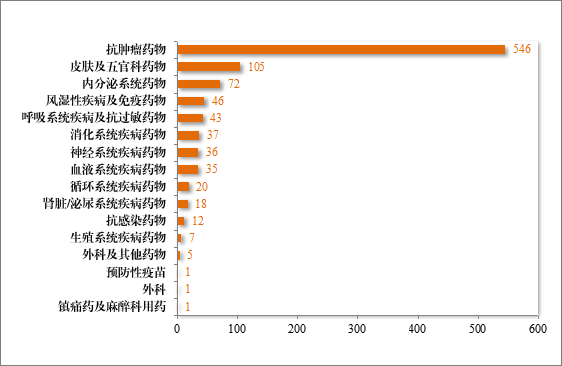
图 37 2024 年批准治疗用生物制品 IND 的适应症领域分布情况(件)
建议批准的治疗用生物制品 NDA 168 件中,抗肿瘤药物占比37.50%,内分泌系统药物占比 15.48%,血液系统疾病药物 12.50%。2024 年建议批准治疗用生物制品NDA 的适应症领域分布情况详见图38。
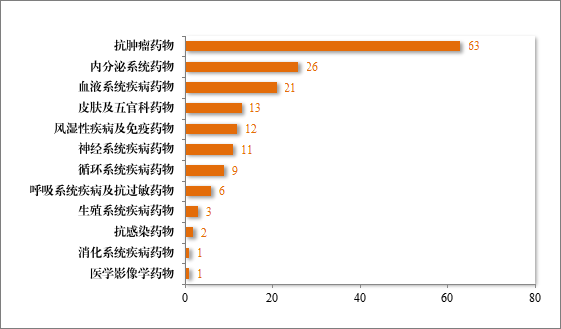
图 38 2024 年建议批准治疗用生物制品 NDA 的适应症领域分布情况(件)
(三)直接行政审批类注册申请审结情况
2024 年审结直接行政审批类注册申请 2204 件,其中无需技术审评的补充申请 1795 件,临时进口注册申请 409 件。2020 年至 2024 年直接行政审批的各类别注册申请审结情况详见图 39。
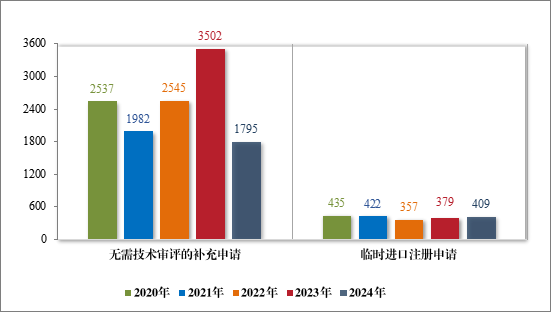
图 39 2020 年至 2024 年直接审批的各类别注册申请审结量(件)
第三章 药品加快上市注册情况
2024 年药审中心通过药品加快上市注册程序,加强与申请人的沟通交流,缩短药物研发与技术审评时间,加快临床急需新药好药上市。
(一)突破性治疗药物程序
药物临床试验期间,用于防治严重危及生命或者严重影响生存质 量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据 表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、 Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性 治疗药物程序。对于纳入突破性治疗程序的药物,其临床试验期间沟 通交流包括首次沟通交流、因重大安全性问题/重大技术问题而召开 的会议、药物临床试验关键阶段会议以及一般性技术问题咨询等,药 审中心优先配置资源进行沟通交流,加强指导并促进药物研发。
2024 年共收到突破性治疗药物程序申请 337 件,同意纳入突破 性治疗药物程序 91 件(84 项适应症,见附件 6),占申请数量的 27.00%,较 2023 年增加 30.00%。
自 2020 年《药品注册管理办法》(总局第 27 号令)实施以来,累计纳入突破性治疗药物程序 294 件(246 项适应症),排名前三的分别为抗肿瘤药物、神经系统疾病药物及抗感染药物,具体适应症分布情况请见图 41。
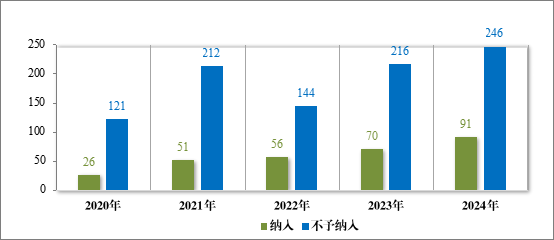
图 40 2020-2024 年突破性治疗药物程序纳入和不予纳入量(件)
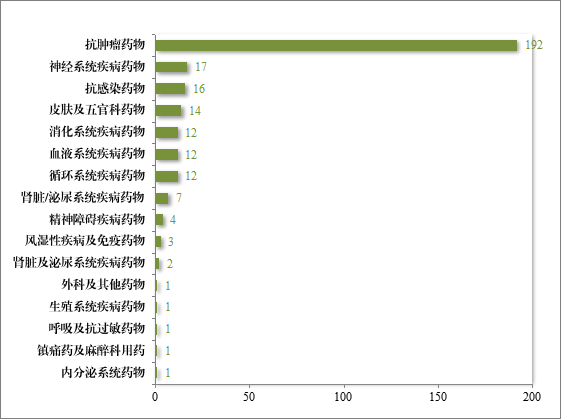
图 41 2020 年至 2024 年纳入突破性治疗药物程序适应症领域分布(件)
(二)附条件批准程序
药物临床试验期间,治疗严重危及生命且尚无有效治疗手段的疾病以及公共卫生方面急需的药品,药物临床试验已有数据显示疗效并能预测其临床价值的,以及应对重大突发公共卫生事件急需的疫苗或者国家卫生健康委员会认定急需的其他疫苗,经评估获益大于风险的,可基于替代终点、中间临床终点或早期临床试验数据而附条件批准上 市。附条件批准上市的目的是缩短药物临床试验的研发时间,使其尽 早应用于无法继续等待的危重疾病或公共卫生方面急需的患者。
2024 年共有 37 件药品注册申请(27 项适应症)附条件批准上市,其中 18 项适应症为首次批准上市,9 项适应症为已上市药品增加适应症(见附件 7)。同时,在 2024 年,共有 9 项附条件批准的适应症完成确证性研究,转为常规批准。
自 2020 年《药品注册管理办法》(总局第 27 号令)实施以来,共有 187 件药品注册申请(135 项适应症)附条件批准上市,包括抗肿瘤药物、新冠疫苗及治疗药物、血液系统疾病药物等,其中抗肿瘤药物数量最多,占比 82.22%,共有 28 项附条件批准的适应症完成确证性研究,转为常规批准,具体请见图 42、图 43。
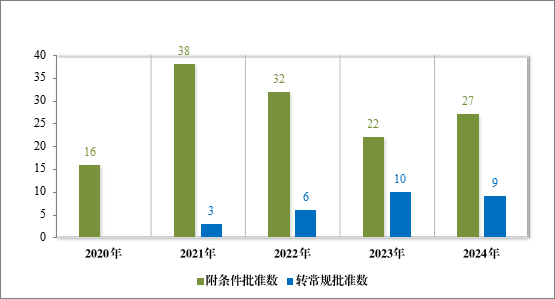
图 42 2020 年至 2024 年附条件批准和转为常规批准情况(按适应症计)
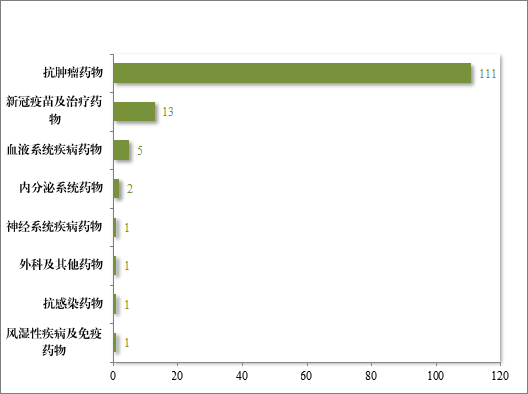
图 43 2020 年至 2024 年附条件批准药品适应症分布情况(按适应症计)
(三)优先审评审批程序
药品上市许可申请时,对于以下具有明显临床价值的药品,可以申请适用优先审评审批程序:(一)临床急需的短缺药品、防治重大传染病和罕见病等疾病的创新药和改良型新药;(二)符儿童生理特征的儿童用药品新品种、剂型和规格;(三)疾病预防、控制急需的疫苗和创新疫苗;(四)纳入突破性治疗药物程序的药品;(五)符各附条件批准的药品;(六)国家药监局规定其他优先审评审批的情形。适用优先审评审批程序的上市注册申请的审评时限由常规程序的200 日缩短为 130 日,其中临床急需境外已上市罕见病用药的审评时限为 70 日。
2024 年共纳入优先审评审批注册申请 124 件(88 个品种),同比增加 14.81%,具体纳入情况见图 44;2024 年按照优先审评审批程序批准 110 件注册申请(74 个品种,其中 2 个品种新准上市后,同年又批准新适应症)上市,同比增加 29.41%。
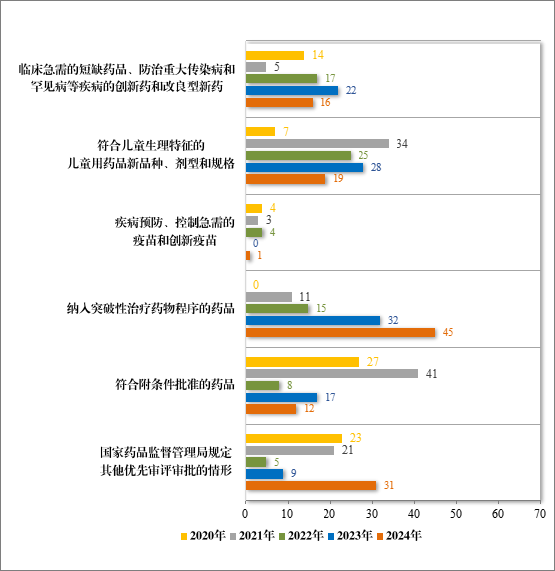
图 44 2020 年至 2024 年根据现行《药品注册管理办法》纳入优先审评审批程序的注册申请情况(件)
自 2020 年《药品注册管理办法》(总局第 27 号令)实施以来,共有 496 件药品注册申请纳入优先审评审批程序,包括抗肿瘤药物、皮肤及五官科药物、内分泌系统药物等,其中抗肿瘤药物数量最多,占比 42.54%,具体请见图 45。
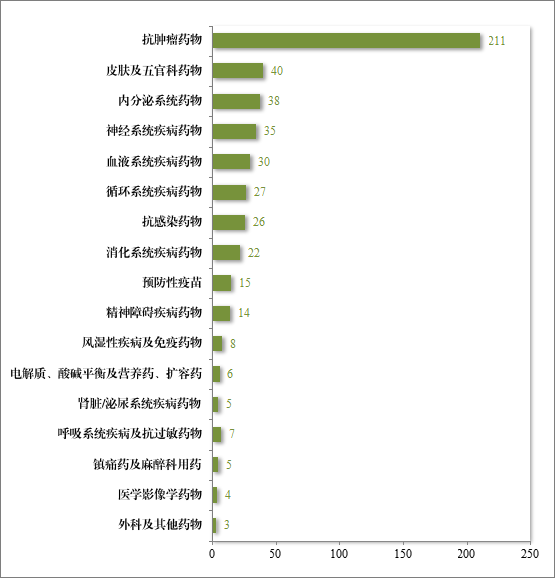
图 45 2020 年至 2024 年按现行《药品注册管理办法》纳入优先审评审批程序品种适应症分布情况
第四章 药品研发与审评沟通交流
沟通交流是在药物研发与注册申请过程中,申请人与药审中心就关键技术问题等所进行的沟通交流,是药审中心鼓励药物创新,提高审评审批质效,促进医药产业高质量发展的重要举措之一。
(一)沟通交流会议申请与办理情况
2024 年药审中心共接收沟通交流会议申请 5554 件,办理沟通交流会议申请 4912 件,为 1575 家企业的 3551 个品种(按照申请人提交沟通交流申请时的药品名称计,下同)提供了沟通交流服务,其中召开面对面会议/电话会议 691 个,同比增加 12.91%。2020 年至 2024年接收及办理沟通交流会议申请情况详见图 46。
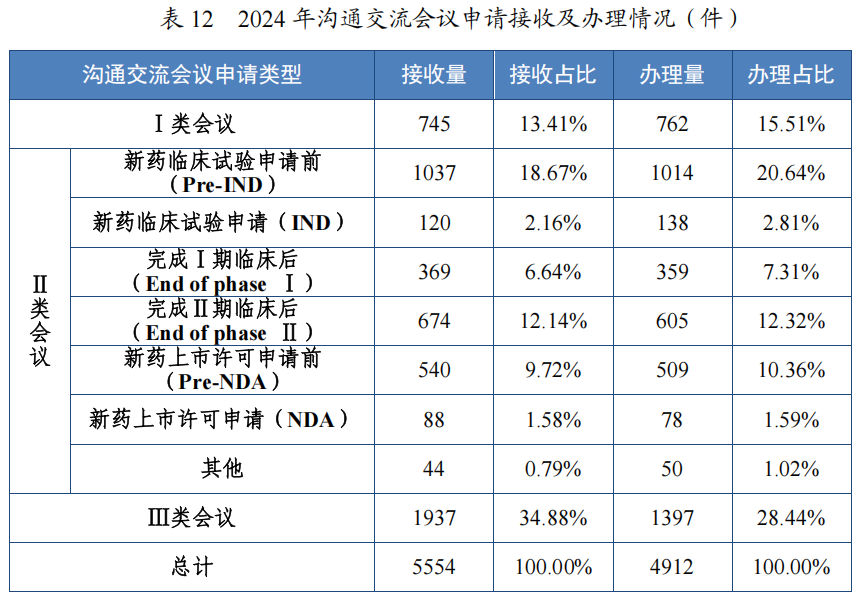
2024 年,药审中心办理沟通交流会议申请 4912 件,在药物研发关键阶段办理的Ⅱ类会议占比 56.05%,其中新药临床试验申请前(Pre-IND)沟通交流会议申请占比 20.64%,新药上市许可申请前(Pre-NDA)沟通交流会议申请占比 10.36%。2024 年沟通交流会议申请接收及办理情况详见表 12。
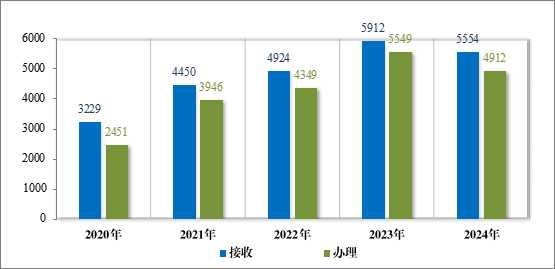
图 46 2020 年至 2024 年接收及办理沟通交流会议申请情况(件)
(二)一般性技术问题咨询情况
2024 年接收一般性技术问题咨询 16156 个,为 3590 家企业解答一般性技术问题咨询 15449 个,及时总结梳理共性问题,并在中心网站予以发布,2024 年按程序发布 7 批共 31 个常见一般性技术问题解答,涵盖了注册受理、技术审评等方面,累计发布 240 个共性问题2,2020 年至 2024 年接收及办理一般性技术问题咨询量详见图 47。
2 见链接:https://www.cde.org.cn/main/xxgk/listpage/07edef25f1e7354bfd8490baa0ce056b
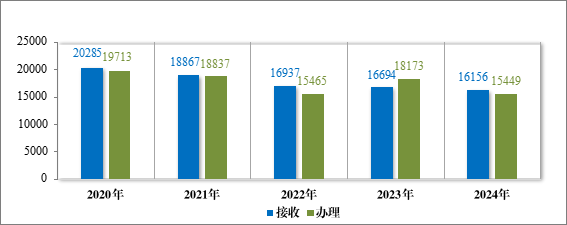
图 47 2020 年至 2024 年接收及办理一般性技术问题咨询量(个)
第五章 完善药品技术指导原则体系
(一)制定发布药品技术指导原则
2024 年药审中心新发布技术指导原则 73 个(详见附件 8),累计发布技术指导原则达 555 个3。3 见链接:https://www.cde.org.cn/zdyz/index
1. 聚焦国际前沿技术领域,持续完善放射性药物、细胞和基因治疗领域技术评价体系
为鼓励放射性药物的创新研发,参考国外相关指南并结国内申报情况,制定发布了《氟[18F]化钠注射液仿制药药学研究技术要求(试行)》《放射性化学仿制药药学研究技术指导原则》《放射性治疗药物非临床研究技术指导原则》3 个技术指导原则。
为加快完善细胞和基因治疗产品技术评价体系,鼓励探索新技术和新方法,发布了《可复制型慢病毒检测共性问题与技术要求》,在细胞治疗产品领域发布了《细胞治疗产品临床药理学研究技术指导原则(试行)》《间充质干细胞防治移植物抗宿主病临床试验技术指导原则(试行)》《人源干细胞产品非临床研究技术指导原则》《嵌合抗原受体 T 细胞治疗血液淋巴系统恶性肿瘤临床试验技术指导原则(试行)》,在基因治疗产品领域发布了《重组腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则》《腺相关病毒载体基因治疗产品非临床研究技术指导原则》。
2. 持续丰富符合中药特点的技术标准体系
鼓励以临床价值为导向,围绕临床应用优势和特点进行中药改良型新药研发,发布《中药改良型新药研究技术指导原则(试行)》;探索和丰富“中医药理论、人用经验和临床试验相结”的注册审评证据体系在具体适应症领域应用的疗效评价标准,发布《中药新药用于紧张型头痛的临床疗效评价技术指导原则(试行)》《小儿便秘中药新药临床研发技术指导原则(试行)》。
贯彻落实《中共中央 国务院关于促进中医药传承创新发展的意 见》中“支持珍稀濒危中药材替代品的研究和开发利用”的相关要求, 制定发布了《濒危动物类中药材人工制成品研究技术指导原则(试行)》《替代或者减去已上市中药处方中濒危药味研究技术指导原则(试行)》。
为加强中药制剂生产过程质量控制,促进新技术、新方法、新设备在中药生产中的应用,制定发布了《中药口服制剂生产过程质量控制研究技术指导原则(试行)》;完善中药整体质量评价,制定发布了《中药制剂特征图谱研究技术指导原则(试行)》《中药制剂稳定性研究技术指导原则(试行)》;加快推进中药 3.1 类研发与注册,制定发布了《按古代经典名方目录管理的中药复方制剂药学申报资料撰写指导原则(试行)》。
3. 以问题为导向,持续完善技术标准体系
结合化学药物研发常见共性问题,对《已上市化学药品药学变更研究技术指导原则(试行)》进行补充完善,制定发布了原料药变更的问答;发布了《化学药品注射剂配伍稳定性药学研究技术指导原则(试行)》;完善研发生产主体合规信息管理的长效机制,发布《药品注册研发生产主体 规信息管理与审查指导原则(试行)》。
规信息管理与审查指导原则(试行)》。
结合生物制品研发常见问题,制定发布了《抗体偶联药物分段生产试点注册申报技术要求》《抗体偶联药物药学研究与评价技术指导原则》;为加强治疗用重组蛋白产品在研发和生产过程中的质量控制,发布了《治疗用重组蛋白产品临床试验申请病毒清除工艺平台验证技术指导原则(试行)》。进一步完善变更相关技术要求,制定发布了《临床试验期间生物制品药学研究和变更技术指导原则(试行)》《已上市疫苗药学变更研究技术指导原则(试行)》。
持续完善疫苗技术评价体系,制定发布了《疫苗免疫原性桥接临床试验技术指导原则(试行)》《疫苗临床试验统计学指导原则(试行)》《多糖结合疫苗药学研究及评价技术指导原则(试行)》。同时,聚焦具体品种研发特点,制定发布了《脑膜炎球菌疫苗临床试验技术指导原则(试行)》《预防用猴痘疫苗临床试验技术指导原则(试行)》等。
4. 加大力度解决特殊群体的用药需求问题,提高药物研发评价体系覆盖率
为优化适合于儿童、吞咽困难等患者群体药物研发,发布了《微型片剂(化学药品)药学研究技术指导原则(试行)》。为生长激素缺乏症创新药临床试验设计提供指导,制定发布了《生长激素制剂用于生长激素缺乏症临床试验技术指导原则》。
紧跟国际监管趋势,制定发布《罕见病基因治疗产品临床试验技术指导原则(试行)》《罕见病酶替代疗法药物非临床研究指导原则(试行)》,及时为罕见病药物研发提供指导。正式引入“去中心化临床试验”理念,发布了《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》,为罕见病药物临床试验提供更加灵活、可及的新方法、新路径。
在具体适应症领域,制定发布了《治疗慢性心力衰竭药物临床试验技术指导原则》《胃食管反流病治疗药物临床试验技术指导原则》《慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则》《抗肿瘤药物说明书安全性信息撰写技术指导原则》等技术指导原则。
5. 注重药品研发关键技术要求,助力新药研发提质加速
在共性技术要求方面,发布了《化学药改良型新药临床药理学研究技术指导原则(试行)》《放射性标记人体物质平衡研究技术指导原则》《模型引导的创新药物剂量探索和优化技术指导原则》等,进一步丰富临床药理学评价体系。
参考国际技术要求制定了《基于药代动力学方法支持用于肿瘤治疗的抗 PD-1/PD-L1 抗体可选给药方案的技术指导原则》《抗肿瘤药物临床试验中 SUSAR 分析与处理技术指导原则》《评价胰岛素类药物药代和药效动力学的正葡萄糖钳夹试验指导原则》《药物免疫毒性非临床研究技术指导原则》等,提高企业研发效率。
6. 总结仿制药申报共性问题,推动仿制药高质量发展
口服溶液剂作为临床常用的剂型,对于儿童和老年患者具备临床使用方面的优势。为提高此类产品的研发质量,发布了《化学药品仿制药口服溶液剂药学研究技术指导原则》;结国内外相关指导原则和仿制药研发特点,制定发布《化学仿制药注射剂过量灌装研究技术指导原则》《化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则》《低分子量肝素类仿制药药学研究与评价技术指导原则(试行)》。
7. 完善个药技术指导原则体系
制定了 16 个生物等效性个药技术指导原则;针对生物制品具体品种发布了《司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则》《地舒单抗注射液生物类似药(肿瘤适应症)临床试验指导原则(试行)》,进行针对性指导。
(二)推动ICH 指导原则转化实施
1. 国家药监局成功连任新一届 ICH 管委会成员
国家药监局于 2024 年 6 月ICH 会议上被推选为新一届 ICH 管委会成员,此次为国家药监局第三次当选。自 2017 年加入 ICH 以来,国家药监局在新药研发及注册技术标准与国际规则接轨方面,取得了长足进步。截至 2024 年 12 月,国家药监局已采纳实施了当前全部 71个 ICH 指导原则。根据 2024 年监管科学创新中心(Centre for Innovation in Regulatory Science,CIRS)调查结果,国家药监局实施和遵循ICH 指导原则的情况较 2021 年相比成效显著,与欧美日等其他国际监管机构成员实施和遵循的程度趋同。
药审中心建立完善 ICH 议题协调和实施工作机制,研究制定 ICH指导原则实施时间表和路线图,在充分听取工业界和学界意见的基础上,2024 年共报国家药监局发布 6 个 ICH 指导原则适用公告,包括《Q14:分析方法开发》《M12:药物相互作用》《E11A:儿科外推》等 7 个 ICH 指导原则,进一步推动药品注册技术要求全面与国际接轨,实现药品注册技术标准统一、规则统一。
此外,国家药监局 ICH 代表分别参加了 2024 年 ICH 里斯本、福冈和蒙特利尔会议,深度参与国际监管规则的制定,及时跟进议题内容的技术交流与探讨,适时分享中国药品监管经验,获得国际方肯定。截至 2024 年 12 月,国家药监局共向 45 个 ICH 协调议题工作组选派了具有丰富专业背景经验的专家 79 人,共计参与 ICH 日常工作电话会议 593 次。
2. 促进监管机构和工业界互动多样化
为进一步促进工业界在审评注册工作实践中对 ICH 指导原则的准确理解,截至 2024 年 12 月,ICH 工作办公室共组织举办 ICH 指导原则专家研讨会 14 场和宣贯培训 3 场,并在 DIA 欧洲年会、ICH展望会、国际生物医药产业创新北京论坛等平台参与了 ICH 专题活动,一方面积极宣传了中国 ICH 工作进展,另一方面对外传递出与国际良好监管实践保持一致的积极开放态度。通过组织多种形式的对话交流,监管机构和工业界聚焦 ICH 指导原则在中国落地实施过程中面临的问题或挑战,围绕具体案例进行讨论,促进彼此之间的理解,进而构筑共识,更好促进ICH 指导原则的实施和遵循。
第六章 药品监管科学研究
药审中心聚焦国际药品监管前沿技术,结国家科技发展战略要求,依托药品监管科学全国重点实验室、“中国药品监管科学行动计划”平台,组织实施了 38 项药品监管科学研究,过程中与产学研监等相关方持续互动交流,开展了 22 次公开宣讲,发表了 12 篇学术论文,固化新的监管理念,形成 25 个技术指导原则,9 篇调研报告,将新科学引入药品审评过程,协助解决临床和监管急需问题,推动新技术转化应用和产业高质量发展。
(一)研究项目
药审中心本年度组织实施的药品监管科学研究主要分为以下四类:
1. 指导药物研发新技术应用
细胞和基因治疗产品、小核酸药物、mRNA 疫苗、多糖结疫苗、人用疫苗新型佐剂技术、放射性药物、皮肤外用、鼻用、眼用等局部起效半固体化学制剂等。
2. 助力药物研发新工具的应用
人工智能技术临床研发应用、数字健康技术在去中心化临床试验的应用、真实世界证据应用、模型引导的药物研发、以患者为中心的药物研发、疫苗平台技术、类器官/器官芯片、新颖临床试验设计等。
3. 满足临床需求和疾病治疗
四大慢性疾病、重大突发新发传染病、神经系统疾病、血液系统疾病、特殊人群用药、抗多重耐药细菌药物等。
4. 完善科学监管工具
推动eCTD 的实施、智能化临床试验风险预测及分析等。
(二)合作与沟通
药审中心持续强化协同创新,完善合作机制,凝聚行业顶尖研究力量,与 28 家产学研监机构合作开展前沿技术研究以及重大创新项目的研审联动,促进创新成果转化。
1. 整合优势资源,共同推动特殊人群药物研发和转化
药审中心定位老年人群重大疾病领域,围绕科技重大专项支持的创新药品,建立了前沿成果加速转化和应用的协同创新合作平台,集聚 6 家国家老年医学中心/国家老年疾病临床医学研究中心,3 家高校科研机构优势力量,联合攻关,探索可用于表征参加临床试验的老年人群的生理、心理和社会状况的工具,用最合适的人群产出科学可靠的试验数据,并用以支持在老年人群中进行药物获益-风险评估。结合老年人群特点在创新药研发中开展适老化设计,开发出更适合老年人使用的药物。后续在相关技术标准起草过程中,持续与学术界、产业界和患者组织进行交流,传递并完善相关研发和监管理念。
2. 跨领域合作推动新技术发展和转化应用
药审中心积极探索类器官和器官芯片等仿生模型技术在研发中 的应用与评价方法,与 6 家高校科研机构合作建立肝、肠、心脏、肿 瘤模型等类器官或器官芯片方法,开展类器官或器官芯片方法学验证,建立评价类器官、器官芯片生理生化及功能的标准认证和监管技术标 准,鼓励使用高性价比平台提高研发效率。
3. 在药品监管科学研究中引入患者声音
药审中心成立专项课题组,开展“重点疾病领域以患者为中心药物研发和评价技术标准”研究,与患者组织代表、研发企业、临床研究者代表等多方共同研讨,听取各方意见,分析“以患者为中心”药物研发现状、面临的挑战及下一步努力方向。在此基础上,课题组就重大慢病领域中神经退行性疾病、自身免疫性疾病、罕见病等患者感受和体验数据等进行了深入研究,用于药品技术标准体系建设,以支持相关领域创新药物的科学研发和监管决策。同时,将研究成果作为 ICH 专家工作组参与 ICH 新议题《E22:患者偏好研究的一般考虑》协调的重要考量。
4. 积极探索战略层面“研审联动”机制
药审中心与行业顶尖研究机构建立持久的学术合作关系,共同开展药品监管科学研究,以适应日新月异的科学技术发展,更好地利用新技术指导监管决策,从而促进创新产品转化,服务国家科技发展战略。目前,已与广州国家实验室建立合作关系,推动开展新型疫苗研发平台技术确认及评价体系、重大呼吸慢病新药研发的关键技术等项目研究,探索解决研发共性问题,推动创新成果转化,并以此为蓝本,持续扩展对外合作,强化监管科学研究合力。
(三)研究成果与转化
1. 鼓励和支持源头创新,“中国制药”含金量不断提升
为鼓励和支持新药研发,药审中心自 2019 年实施药品监管科学研究以来,先后聚焦细胞和基因治疗产品、新型疫苗、小核酸药物、放射性药物等领域探索建立新工具、新标准。在细胞和基因治疗领域,先后研究起草发布 30 余个技术指导原则,其中本年度研究起草细胞和基因治疗产品申报沟通交流、临床试验设计、体内过程评价、临床获益-风险评价等 8 个技术指导原则。
我国已有多款小核酸药物获批临床,药审中心正在加快推进小核酸药物监管科学项目研究,尽快研究起草相关技术指导原则,助力我国小核酸药物创新实现突破。
2. 满足临床急需,按下惠及患者“加速键”
药审中心开展了 mRNA 疫苗、多糖结合疫苗、多联疫苗、人用疫苗新型佐剂技术等领域评价标准研究,2021 年以来先后研究起草了 15 个药品技术指导原则,将 WHO、ICH 等监管理念、先进的分析方法及分析工具引入我国疫苗监管考虑中,补齐我国疫苗监管短板,满足我国计划免疫亟需加强的临床需求。其中,本年度发布了多糖结合疫苗药学技术评价指导原则,推动了 7 个多糖结 疫苗进入临床,对 12 个多糖结
疫苗进入临床,对 12 个多糖结 疫苗进行临床前技术指导,其中涉及多个高价次迭代疫苗,如 24 价、26 价肺炎球菌多糖结合疫苗等。本年度药审中心研究起草了预防用 mRNA 疫苗非临床研究技术指导原则,提高国际标准制定的参与度,提升我国 mRNA 疫苗研发自主率。另外,药审中心研究起草了专门针对疫苗佐剂的非临床研究技术指导原则,弥补监管短板,促进相关产品研发进程,已批准 10 个含新型佐剂的疫苗开展临床试验,正在推进 2 个含新型佐剂疫苗的上市审评审批,疫苗种类包括流感病毒疫苗、呼吸道合胞病毒疫苗、带状疱疹疫苗、狂犬病疫苗、结核病疫苗、新型冠状病毒疫苗等。
疫苗进行临床前技术指导,其中涉及多个高价次迭代疫苗,如 24 价、26 价肺炎球菌多糖结合疫苗等。本年度药审中心研究起草了预防用 mRNA 疫苗非临床研究技术指导原则,提高国际标准制定的参与度,提升我国 mRNA 疫苗研发自主率。另外,药审中心研究起草了专门针对疫苗佐剂的非临床研究技术指导原则,弥补监管短板,促进相关产品研发进程,已批准 10 个含新型佐剂的疫苗开展临床试验,正在推进 2 个含新型佐剂疫苗的上市审评审批,疫苗种类包括流感病毒疫苗、呼吸道合胞病毒疫苗、带状疱疹疫苗、狂犬病疫苗、结核病疫苗、新型冠状病毒疫苗等。
聚焦临床急需和产品监管需要,药审中心通过开展系列监管科学项目研究,研究起草了阿尔茨海默病治疗药物、慢性丁型肝炎病毒感染治疗药物、抗菌药物、罕见病药物、老年人群治疗药物等相关技术指导原则。
药审中心建立了阿尔茨海默病治疗产品技术评价标准,推动相关产品通过优先审评程序在我国与国外监管机构同步批准上市,近两年共批准 8 款 1 类或 2.4 类新药开展临床试验。
药审中心结合近年丁肝治疗新药及乙肝功能性治愈新药的新进展,参考学术界和业界对新药临床试验设计的技术考量,与科研院所、疾控机构合作,探索实现数据互通互享,相关研究成果数据及时指导新药临床试验设计,发布了《慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则》,对受试人群、主要终点、试验周期等提出了更为清晰具体的、可实操的技术建议。
3. 促进中药传承创新发展
大力发展中药监管科学,将研究成果转化为 19 个相关技术指导原则。本年度研究起草 6 个,包括中药口服制剂生产过程质量控制研究、中药制剂稳定性研究、古代经典名方中药复方制剂研究等评价标准。推动 8 个按古代经典名方目录管理的中药复方制剂(即中药 3.1类)研发上市,加快 12 个品种研发进程。
第七章 药品研发与技术审评宣贯与培训
2024 年,药审中心围绕申请人关注的热点难点问题,以线上线下相结合方式构建多元化宣贯形式,助力提升医药产业研发水平。
按照 2024 年全国药品监督管理工作会议部署,为进一步完善与申请人的沟通交流服务机制,加强对申请人的服务,加大对药品注册相关政策和技术要求的宣贯力度,2024 年药审中心开设了“药审云课堂”,于每月第 1 个周五下午定期在线举办,就申请人关心的常见共性问题进行交流,及时对新发布的药品注册相关政策或技术要求进行宣贯。2024 年共举办 12 期,15 万余人在线观看(含回看数据),培训议题涉及 71 个,包括申报资料撰写要点与受理常见问题解析、创新药临床研发技术考虑、 各类药品审评常见问题解析等;同时聚焦补充申请试点、推动仿制药高质量研发、鼓励创新等中心重点工作开展专题解读,具体清单详见附件 9。
推出“药审云课堂平台”,对 2024 年开展的 71 门课程重新整理并细化分类,观看界面友好便捷,同步开设直播入口、课程中心、提问和互动等模块,帮助申请人更加全面、透彻地掌握相关技术要求和监管考虑。
同时,药审中心赴东北地区、京津冀地区、成渝地区、长三角地区、粤港澳大湾区以线下形式开展药品注册技术系列培训班 10 场,涉及 14 个培训专题,内容覆盖中药、化学药、生物制品药物研发共性问题与申报常见问题交流,以及化学药自评估报告、放射性药物研发、儿童用药等热点专题,共计 8000 余人参训,针对性解决区域内企业药品研发中存在的痛点难点问题,加快产品研发申报进程,助力区域医药产业高质量发展。
第八章 2024年度药品审评主要工作回顾4
4 2024 年药审中心发布的指导原则和开展的培训见附件 8、附件 9,未列入主要工作回顾。
(一) 2024 年 1 月 5 日,国家药监局发布关于适用《M7(R2):评估和控制药物中 DNA 反应性(致突变)杂质以限制潜在致癌风险》国际人用药品注册技术协调会指导原则的公告,自 2024 年 1 月 3 日开始的相关研究(以试验记录时间点为准),均适用 M7(R2)指导原则正文、问答及附录。
(二) 2024 年 1 月 24 日,药审中心发布《国家药监局药审中心关于定期举办“药审云课堂”的通知》,定于每月第 1 个周五下午定期在线举办“药审云课堂”,就申请人关心的常见共性问题进行交流,及时对新发布的药品注册相关政策或技术要求进行宣贯。
(三) 2024 年 2 月 7 日,国家药监局发布《优化药品补充申请审评审批程序改革试点工作方案》,在有能力、有条件的省级药品监管部门开展试点工作,试点省级药品监管部门按照“提前介入、一企一策、全程指导、研审联动”的原则,为辖区内药品重大变更申报前提供前置指导、核查、检验和立卷服务,大幅缩短需要核查检验补充申请的技术审评用时。
(四) 2024 年 2 月 7 日,药审中心发布《药物研发与技术审评沟通交流会议申请资料参考》,分别制定了中药、化学药品、生物制品的药物研发与技术审评沟通交流会议申请资料参考,供注册申请人准备沟通交流会议申请资料时参考。
(五) 2024 年 4 月 17 日,药审中心发布《药审中心关于已上市药品说明书增加儿童用药信息工作细则(试行)》,明确《已上市药品说明书增加儿童用药信息工作程序(试行)》中品种遴选范围、说明书修订与审核流程,以及品种申报程序等相关配套文件的要求。
(六) 2024 年 4 月 23 日,国家药监局发布《关于优化已在境内上市的境外生产药品转移至境内生产的药品上市注册申请相关事项的公告》,为进一步优化外商投资环境,促进医药行业高质量发展,公告提出简化申报资料要求,实施优先审评审批等鼓励措施。
(七) 2024 年 5 月 9 日,药审中心发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)》,明确了进口化学药品转移至境内生产的具体申报要求。
(八) 2024 年 5 月 22 日,国家药监局发布关于适用《Q5A(R2):来源于人或动物细胞系生物技术产品的病毒安全性评价》国际人用药品注册技术协调会指导原则的公告,规定自 2025 年 5 月 21日开始的相关研究(以试验记录时间点为准),均适用 Q5A(R2)指导原则。
(九) 2024 年5 月28 日,国家药监局发布关于适用《Q2(R2):分析方法验证》《Q14:分析方法开发》国际人用药品注册技术协调会指导原则的公告,规定自 2024 年 11 月 24 日开始的相关研究(以试验记录时间点为准),均适用 Q2(R2)/Q14 指导原则。
(十) 2024 年 5 月 31 日,药审中心网站“儿童用药专栏”开始持续公示优先审评审批的儿童用药批准信息,使研发单位更好地了解与把握儿童用药创新研发方向。
(十一) 2024 年 6 月 4 日,国家药监局第三次当选 ICH 管委会成员,表明我国在新药研发及注册技术标准方面与国际规则接轨,药品监管国际化进程方面得到国际认可。
(十二) 2024 年 6 月 14 日,药审中心发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(治疗用生物制品)》,明确了进口治疗用生物制品转移至境内生产的具体申报要求。
(十三) 2024 年 6 月 25 日,国家药监局发布关于适用《Q3C(R9):杂质:残留溶剂的指导原则》国际人用药品注册技术协调会指导原则的公告,规定自 2024 年 6 月 20 日起开始的相关研究(以试验记录时间点为准),均适用 Q3C(R9)指导原则。
(十四) 2024 年 7 月 1 日,为贯彻落实《国务院办公厅关于全面加强药品监管能力建设的实施意见》有关要求,提升“互联网+药品监管”应用服务水平,药审中心建立了电子申报资料网络传输通道,在使用光盘提交电子申报资料的基础上,增加网络传输方式,为申请人提交电子申报资料提供多种选择,以提升申请人电子申报资料提交效率。
(十五) 2024 年 7 月 31 日,国家药监局发布《优化创新药临床试验审评审批试点工作方案》,进一步优化临床试验审评审批机制,实现 30 日内完成创新药临床试验审评审批,大幅缩短药物临床试验启动用时。
(十六) 2024 年 9 月 13 日,药审中心发布《以患者为中心的罕见疾病药物研发试点工作计划(“关爱计划”)》,指导和帮助研发单位在罕见疾病药物研发全程充分倾听患者声音,推动以患者为中心的罕见疾病药物研发和上市。
(十七) 2024 年 10 月 22 日,国家药监局发布《生物制品分段生产试点工作方案》,探索部分创新生物制品、临床急需生物制品的分段生产,推动生物医药产业优化资源配置,有序融入国际产业链,促进产业高质量发展。2024 年 11 月 7 日,药审中心关于发布《抗体偶联药物分段生产试点注册申报技术要求》。
(十八) 2024 年 10 月 23 日,药审中心发布《已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(预防用生物制品)》,明确了进口预防用生物制品转移至境内生产的具体申报要求。
(十九) 2024 年 11 月 1 日起,药审中心对创新药以及经沟通交流确认可纳入优先审评审批程序和附条件批准程序的品种上市许可申请提供受理靠前服务。上市许可申请递交前,申请人可就受理相关问题向药审中心、药品长三角分中心、药品大湾区分中心提出受理靠前服务申请。
(二十) 2024 年11 月1 日,国家药监局发布关于适用《M12:药物相互作用研究》国际人用药品注册技术协调会指导原则及问答文件的公告,规定自 2024 年 10 月 29 日起开始的相关研究(以试验记录时间点为准),均适用 M12 指导原则及问答文件。
(二十一) 2024 年 11 月 19 日,国家药监局发布关于适用《E11A:儿科外推》国际人用药品注册技术协调会指导原则的公告,规定自 2024 年 11 月 18 日起开始的相关研究(以试验记录时间点为准),均适用 E11A 指导原则。
(二十二) 2024 年 11 月 22 日,国家药监局发布同意北京等十省(市)开展优化药品补充申请审评审批程序改革试点的批复意见,加快推进补充申请试点工作进展。
结语
征程万里风正劲,重任千钧再扬帆。2025 年是“十四五”规划收官之年,也是落实全面深化药品监管改革各项举措的关键一年,药审中心将在国家药监局党组的坚强领导下,深入学习贯彻党的二十大和二十届二中、三中全会精神,以钉钉子精神抓好《关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》的贯彻落实,推进优化药品补充申请审评审批程序等改革试点工作,加大对研发创新的支持力度,加强药品注册申报前置指导,加快临床急需药品审评审批,推动审评技术要求与国际接轨,支持开展国际多中心临床试验,促进全球药物在中国同步研发、同步申报、同步审批、同步上市,完善中药审评审批体系,聚焦医药创新前沿领域发展药品监管科学,加快开发和应用监管新工具、新标准、新方法,推进药品审评审批信息化建设,加强审评审批人才队伍建设,切实保障人民群众用药安全有效,为推进中国式现代化贡献药审力量。
附件 5 2024 年国家药监局批准的药品纳入加快上市程序情况
| 序号 | 药品名称 | 上市许可持有人 | 首次批准上市/增加适应症 | 突破性治疗药物程序 | 附条件批准程序 | 优先审评审批程序 |
|---|---|---|---|---|---|---|
| 1 | 艾帕洛利托沃瑞利单抗注射液 | 齐鲁制药有限公司 | 首次批准上市 | √ | ||
| 2 | 艾曲泊帕乙醇胺干混悬剂 | 山东则正医药技术有限公司 | 首次批准上市 | √ | ||
| 3 | 奥德昔巴特胶囊 | Ipsen Pharma | 首次批准上市 | √ | ||
| 4 | 贝组替凡片 | MERCK SHARP & DOHME (UK)LIMITED | 首次批准上市 | √ | ||
| 5 | 本维莫德乳膏 | 上海泽德曼医药科技有限公司 | 首次批准上市 | √ | ||
| 6 | 苯乙酸钠苯甲酸钠注射用浓溶液 | 安徽沃泰生物医药有限公司 | 首次批准上市 | √ | ||
| 7 | 泊那替尼片 | Otsuka Pharmaceutical Co., Ltd. | 首次批准上市 | √ | ||
| 8 | 醋酸氟氢可的松片 | ASPEN PHARMA TRADINGLIMITED | 首次批准上市 | √ | ||
| 9 | 醋酸锌片 | Nobelpharma Co., Ltd. | 首次批准上市 | √ | ||
| 10 | 对乙酰氨基酚栓 | 浙江尔婴药品有限公司 | 首次批准上市 | √ | ||
| 11 | 多奈单抗注射液 | Eli Lilly and Company | 首次批准上市 | √ | √ | |
| 12 | 恩朗苏拜单抗注射液 | 石药集团巨石生物制药有限公司 | 首次批准上市 | √ | ||
| 13 | 二氮嗪口服混悬液 | 宿州亿帆药业有限公司 | 首次批准上市 | √ | ||
| 14 | 伐莫洛龙口服混悬液 | Santhera Pharmaceuticals(Deutschland)GmbH | 首次批准上市 | √ | √ | |
| 15 | 氟泽雷塞片 | 信达生物科技有限公司 | 首次批准上市 | √ | √ | √ |
| 16 | 戈利昔替尼胶囊 | 迪哲(江苏)医药股份有限公司 | 首次批准上市 | √ | √ | |
| 17 | 格索雷塞片 | 上海正大天晴医药科技开发有限公司 | 首次批准上市 | √ | √ | √ |
| 18 | 己二酸他雷替尼胶囊 | 葆元生物医药科技(杭州)有限公司 | 首次批准上市 | √ | √ | √ |
| 19 | 加那索龙口服混悬剂 | Marinus Pharmaceuticals, Inc. | 首次批准上市 | √ | ||
| 20 | 甲氨蝶呤注射液 | 四川汇宇制药股份有限公司 | 首次批准上市 | √ | ||
| 21 | 可伐利单抗注射液 | Roche Pharma (Schweiz) AG | 首次批准上市 | √ | √ | |
| 22 | 磷酸奥唑司他片 | Recordati Rare Diseases | 首次批准上市 | √ | ||
| 23 | 磷酸二氢钠磷酸氢二钠颗粒 | 嘉实(湖南)医药科技有限公司 | 首次批准上市 | √ | ||
| 24 | 硫酸阿托品滴眼液 | 沈阳兴齐眼药股份有限公司 | 首次批准上市 | √ | ||
| 25 | 仑卡奈单抗注射液 | Eisai Inc. | 首次批准上市 | √ | ||
| 26 | 马来酸阿可替尼片 | AstraZeneca Pty Ltd | 首次批准上市 | √ | ||
| 27 | 玛伐凯泰胶囊 | Bristol-Myers Squibb Australia PtyLtd | 首次批准上市 | √ | √ | |
| 28 | 莫妥珠单抗注射液 | Roche Pharma (Schweiz) AG | 首次批准上市 | √ | √ | |
| 29 | 佩索利单抗注射液(皮下注射) | Boehringer Ingelheim InternationalGmbH | 首次批准上市 | √ | √ | |
| 30 | 匹妥布替尼片 | Eli Lilly Nederland B.V. | 首次批准上市 | √ | √ | |
| 31 | 瑞普替尼胶囊 | Bristol-Myers Squibb Company | 首次批准上市 | √ | √ | √ |
| 32 | 司普奇拜单抗注射液 | 成都康诺行生物医药科技有限公司 | 首次批准上市 | √ | √ | |
| 33 | 索米妥昔单抗注射液 | ImmunoGen, Inc. | 首次批准上市 | √ | √ | |
| 34 | 特立妥单抗注射液 | Janssen-Cilag International NV | 首次批准上市 | √ | √ | √ |
| 35 | 托夫生注射液 | Biogen MA Inc. | 首次批准上市 | √ | ||
| 36 | 妥拉美替尼胶囊 | 上海科州药物研发有限公司 | 首次批准上市 | √ | √ | |
| 37 | 西达基奥仑赛注射液 | 南京传奇生物科技有限公司 | 首次批准上市 | √ | √ | √ |
| 38 | 熊去氧胆酸口服混悬液 | Dr. Falk Pharma GmbH | 首次批准上市 | √ | ||
| 39 | 盐酸米诺环素泡沫剂 | Journey Medical Corporation | 首次批准上市 | √ | ||
| 40 | 盐酸纳曲酮植入剂 | 深圳善康医药科技股份有限公司 | 首次批准上市 | √ | √ | |
| 41 | 盐酸曲恩汀胶囊 | Navinta LLC | 首次批准上市 | √ | ||
| 42 | 盐酸万古霉素胶囊 | 时森海(杭州)医药科技有限公司 | 首次批准上市 | √ | ||
| 43 | 盐酸西替利嗪滴眼液 | 苏州欧康维视生物科技有限公司 | 首次批准上市 | √ | ||
| 44 | 盐酸伊普可泮胶囊 | Novartis Pharma Schweiz AG | 首次批准上市 | √ | √ | |
| 45 | 盐酸异丙肾上腺素注射液 | 成都欣捷高新技术开发股份有限公司 | 首次批准上市 | √ | ||
| 46 | 依沃西单抗注射液 | 康方赛诺医药有限公司 | 首次批准上市 | √ | √ | |
| 47 | 泽沃基奥仑赛注射液 | 恺兴生命科技(上海)有限公司 | 首次批准上市 | √ | √ | √ |
| 48 | 注射用伏尼凝血素 α | Takeda Pharmaceuticals U.S.A., Inc. | 首次批准上市 | √ | ||
| 49 | 注射用环磷酰胺 | 四川汇宇制药股份有限公司 | 首次批准上市 | √ | ||
| 50 | 注射用利纳西普 | Kiniksa Pharmaceuticals (UK),Ltd. | 首次批准上市 | √ | ||
| 51 | 注射用芦比替定 | PharmaMar AG | 首次批准上市 | √ | √ | |
| 52 | 注射用芦康沙妥珠单抗 | 四川科伦博泰生物医药股份有限公司 | 首次批准上市 | √ | √ | |
| 53 | 注射用罗替高汀微球 | 绿叶嘉奥制药石家庄有限公司 | 首次批准上市 | √ | ||
| 54 | 注射用培妥罗凝血素 α | Novo Nordisk A/S | 首次批准上市 | √ | ||
| 55 | 注射用舒巴坦钠/注射用度洛巴坦钠组包装 | Entasis Therapeutics, Inc. | 首次批准上市 | √ | ||
| 56 | 注射用舒索凝血素 α | Takeda Pharmaceuticals U.S.A., Inc | 首次批准上市 | √ | ||
| 57 | 注射用替朗妥昔单抗 | ADC Therapeutics SA | 首次批准上市 | √ | √ | |
| 58 | 阿布昔替尼片 | Pfizer Inc. | 增加适应症 | √ | ||
| 59 | 艾加莫德 α 注射液(皮下注射) | argenx BV | 增加适应症 | √ | √ | |
| 60 | 贝莫苏拜单抗注射液 | 正大天晴药业集团南京顺欣制药有限公司 | 增加适应症 | √ | √ | √ |
| 61 | 伯瑞替尼肠溶胶囊 | 北京浦润奥生物科技有限责任公司 | 增加适应症 | √ | ||
| 62 | 恩曲替尼胶囊 | Roche Pharma (Schweiz) AG | 增加适应症 | √ | √ | |
| 63 | 呋喹替尼胶囊 | 和记黄埔医药(上海)有限公司 | 增加适应症 | √ | √ | √ |
| 64 | 氟唑帕利胶囊 | 江苏恒瑞医药股份有限公司 | 增加适应症 | √ | √ | |
| 65 | 甲磺酸阿帕替尼片 | 江苏恒瑞医药股份有限公司 | 增加适应症 | √ | √ | |
| 66 | 甲磺酸奥希替尼片 | AstraZeneca AB | 增加适应症 | √ | √ | |
| 67 | 聚乙二醇重组人生长激素注射液 | 长春金赛药业有限责任公司 | 增加适应症 | √ | ||
| 68 | 纳武利尤单抗注射液 | Bristol-Myers Squibb Pharma EEIG | 增加适应症 | √ | √ | |
| 69 | 瑞基奥仑赛注射液 | 上海药明巨诺生物科技有限公司 | 增加适应症 | √ | √ | |
| 70 | 塞利尼索片 | Karyopharm Therapeutics Inc. | 增加适应症 | √ | √ | |
| 71 | 西达本胺片 | 深圳微芯生物科技股份有限公司 | 增加适应症 | √ | √ | |
| 72 | 信迪利单抗注射液 | 信达生物制药(苏州)有限公司 | 增加适应症 | √ | √ | √ |
| 73 | 盐酸阿来替尼胶囊 | Roche Registration GmbH | 增加适应症 | √ | √ | |
| 74 | 盐酸安罗替尼胶囊 | 正大天晴药业集团股份有限公司 | 增加适应症 | √ | √ | √ |
| 75 | 盐酸替洛利生片 | Bioprojet Pharma | 增加适应症 | √ | ||
| 76 | 伊匹木单抗注射液 | Bristol-Myers Squibb Pharma EEIG | 增加适应症 | √ | √ | |
| 77 | 泽布替尼胶囊 | 百济神州(苏州)生物科技有限公司 | 增加适应症 | √ | √ | |
| 78 | 注射用德曲妥珠单抗 | Daiichi Sankyo Europe GmbH | 增加适应症 | √ | √ | √ |
附件8 2024年药审中心发布的指导原则
| 序号 | 通告号 | 指导原则 | 发布时间 |
|---|---|---|---|
| 1 | 2024 年第 1 号 | 基于药代动力学方法支持用于肿瘤治疗的抗 PD-1/PD-L1 抗体可选给药方案的技术指导原则 | 2024/1/10 |
| 2 | 2024 年第 2 号 | 治疗用重组蛋白产品临床试验申请病毒清除工艺平台验证技术指导原则(试行) | 2024/1/16 |
| 3 | 2024 年第 3 号 | 抗肿瘤药物说明书安全性信息撰写技术指导原则 | 2024/1/16 |
| 4 | 2024 年第 4 号 | 放射性标记人体物质平衡研究技术指导原则 | 2024/1/16 |
| 5 | 2024 年第 5 号 | 药物免疫毒性非临床研究技术指导原则 | 2024/1/18 |
| 6 | 2024 年第 6 号 | 人源干细胞产品非临床研究技术指导原则 | 2024/1/18 |
| 7 | 2024 年第 7 号 | 间充质干细胞防治移植物抗宿主病临床试验技术指导原则(试行) | 2024/1/18 |
| 8 | 2024 年第 7 号 | 罕见病基因治疗产品临床试验技术指导原则(试行) | 2024/1/18 |
| 9 | 2024 年第 8 号 | 重组腺相关病毒载体类体内基因治疗产品临床试验申请药学研究与评价技术指导原则 | 2024/1/19 |
| 10 | 2024 年第 9 号 | 放射性治疗药物非临床研究技术指导原则 | 2024/1/24 |
| 11 | 2024 年第 10 号 | 化学药改良型新药临床药理学研究技术指导原则(试行) | 2024/2/4 |
| 12 | 2024 年第 11 号 | 放射性化学仿制药药学研究技术指导原则 | 2024/2/5 |
| 13 | 2024 年第 12 号 | 药品注册研发生产主体规信息管理与审查指导原则(试行) | 2024/2/5 |
| 14 | 2024 年第 13 号 | 微型片剂(化学药品)药学研究技术指导原则(试行) | 2024/2/8 |
| 15 | 2024 年第 14 号 | 抗体偶联药物药学研究与评价技术指导原则 | 2024/2/8 |
| 16 | 2024 年第 15 号 | 低分子量肝素类仿制药药学研究与评价技术指导原则(试行) | 2024/2/22 |
| 17 | 2024 年第 17 号 | 罕见病酶替代疗法药物非临床研究指导原则(试行) | 2024/2/23 |
| 18 | 2024 年第 16 号 | 中药制剂稳定性研究技术指导原则(试行) | 2024/2/27 |
| 19 | 2024 年第 16 号 | 中药制剂特征图谱研究技术指导原则(试行) | 2024/2/27 |
| 20 | 2024 年第 18 号 | 生长激素制剂用于生长激素缺乏症临床试验技术指导原则 | 2024/3/1 |
| 21 | 2024 年第 19 号 | 小儿便秘中药新药临床研发技术指导原则(试行) | 2024/3/1 |
| 22 | 2024 年第 20 号 | 按古代经典名方目录管理的中药复方制剂药学申报资料撰写指导原则(试行) | 2024/4/23 |
| 23 | 2024 年第 21 号 | 中药新药用于紧张型头痛的临床疗效评价技术指导原则(试行) | 2024/5/6 |
| 24 | 2024 年第 23 号 | 恩扎卢胺软胶囊生物等效性研究技术指导原则 | 2024/5/14 |
| 25 | 2024 年第 23 号 | 艾曲泊帕乙醇胺片生物等效性研究技术指导原则 | 2024/5/14 |
| 26 | 2024 年第 23 号 | 注射用醋酸亮丙瑞林微球生物等效性研究技术指导原则 | 2024/5/14 |
| 27 | 2024 年第 23 号 | 奥美拉唑碳酸氢钠胶囊生物等效性研究技术指导原则 | 2024/5/14 |
| 28 | 2024 年第 23 号 | 奥美拉唑碳酸氢钠干混悬剂生物等效性研究技术指导原则 | 2024/5/14 |
| 29 | 2024 年第 23 号 | 注射用醋酸奥曲肽微球生物等效性研究技术指导原则 | 2024/5/14 |
| 30 | 2024 年第 23 号 | 瑞戈非尼片生物等效性研究技术指导原则 | 2024/5/14 |
| 31 | 2024 年第 23 号 | 巯嘌呤片生物等效性研究技术指导原则 | 2024/5/14 |
| 32 | 2024 年第 23 号 | 硫唑嘌呤片生物等效性研究技术指导原则 | 2024/5/14 |
| 33 | 2024 年第 23 号 | 利丙双卡因乳膏生物等效性研究技术指导原则 | 2024/5/14 |
| 34 | 2024 年第 23 号 | 硫辛酸片生物等效性研究技术指导原则 | 2024/5/14 |
| 35 | 2024 年第 23 号 | 依帕司他片生物等效性研究技术指导原则 | 2024/5/14 |
| 36 | 2024 年第 23 号 | 依托咪酯中/长链脂肪乳注射液生物等效性研究指导原则 | 2024/5/14 |
| 37 | 2024 年第 23 号 | 乙酰半胱氨酸颗粒生物等效性研究技术指导原则 | 2024/5/14 |
| 38 | 2024 年第 24 号 | 中药改良型新药研究技术指导原则(试行) | 2024/5/15 |
| 39 | 2024 年第 25 号 | 在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则 | 2024/5/30 |
| 40 | 2024 年第 26 号 | 化学药品注射剂配伍稳定性药学研究技术指导原则(试行) | 2024/6/12 |
| 41 | 2024 年第 28 号 | 化学药品仿制药混悬型鼻用喷雾剂药学研究技术指导原则 | 2024/6/12 |
| 42 | 2024 年第 29 号 | 《已上市化学药品药学变更研究技术指导原则(试行)》原料药变更的问答 | 2024/6/13 |
| 43 | 2024 年第 29 号 | 已上市疫苗药学变更研究技术指导原则(试行) | 2024/6/14 |
| 44 | 2024 年第 29 号 | 临床试验期间生物制品药学研究和变更技术指导原则(试行) | 2024/6/14 |
| 45 | 2024 年第 31 号 | 药物临床试验不良事件相关性评价技术指导原则(试行) | 2024/6/14 |
| 46 | 2024 年第 32 号 | 慢性丁型肝炎病毒感染治疗药物临床试验技术指导原则 | 2024/6/21 |
| 47 | 2024 年第 33 号 | 中药口服制剂生产过程质量控制研究技术指导原则(试行) | 2024/6/24 |
| 48 | 2024 年第 34 号 | 化学仿制药注射剂过量灌装研究技术指导原则 | 2024/7/5 |
| 49 | 2024 年第 35 号 | 化学药品仿制药口服溶液剂药学研究技术指导原则 | 2024/7/8 |
| 50 | 2024 年第 37 号 | 胃食管反流病治疗药物临床试验技术指导原则 | 2024/7/17 |
| 51 | 2024 年第 38 号 | 地舒单抗注射液生物类似药(肿瘤适应症)临床试验指导原则(试行) | 2024/9/19 |
| 52 | 2024 年第 39 号 | 治疗慢性心力衰竭药物临床试验技术指导原则 | 2024/9/19 |
| 53 | 2024 年第 40 号 | 复方甘草酸苷片生物等效性研究技术指导原则 | 2024/9/25 |
| 54 | 2024 年第 40 号 | 地屈孕酮片生物等效性研究技术指导原则 | 2024/9/25 |
| 55 | 2024 年第 41 号 | 疫苗免疫原性桥接临床试验技术指导原则(试行) | 2024/9/25 |
| 56 | 2024 年第 42 号 | 抗肿瘤药物临床试验中 SUSAR 分析与处理技术指导原则 | 2024/10/10 |
| 57 | 2024 年第 44 号 | 氟[18F]化钠注射液仿制药药学研究技术要求(试行) | 2024/10/22 |
| 58 | 2024 年第 45 号 | 可复制型慢病毒检测共性问题与技术要求 | 2024/10/29 |
| 59 | 2024 年第 46 号 | 司美格鲁肽注射液生物类似药体重管理适应症临床试验设计指导原则 | 2024/11/1 |
| 60 | 2024 年第 47 号 | 抗体偶联药物分段生产试点注册申报技术要求 | 2024/11/7 |
| 61 | 2024 年第 48 号 | 基于疾病登记的真实世界数据应用指导原则(试行) | 2024/11/12 |
| 62 | 2024 年第 49 号 | 细胞治疗产品临床药理学研究技术指导原则(试行) | 2024/11/19 |
| 63 | 2024 年第 50 号 | 替代或者减去已上市中药处方中濒危药味研究技术指导原则(试行) | 2024/12/11 |
| 64 | 2024 年第 50 号 | 濒危动物类中药材人工制成品研究技术指导原则(试行) | 2024/12/11 |
| 65 | 2024 年第 54 号 | 药物临床试验样本量估计指导原则(试行) | 2024/12/23 |
| 66 | 2024 年第 53 号 | 模型引导的创新药物剂量探索和优化技术指导原则 | 2024/12/23 |
| 67 | 2024 年第 52 号 | 疫苗临床试验统计学指导原则(试行) | 2024/12/23 |
| 68 | 2024 年第 51 号 | 多糖结疫苗药学研究及评价技术指导原则(试行) | 2024/12/23 |
| 69 | 2024 年第 56 号 | 评价胰岛素类药物药代和药效动力学的正葡萄糖钳夹试验指导原则 | 2024/12/31 |
| 70 | 2024 年第 57 号 | 腺相关病毒载体基因治疗产品非临床研究技术指导原则 | 2024/12/31 |
| 71 | 2024 年第 58 号 | 嵌抗原受体 T 细胞治疗血液淋巴系统恶性肿瘤临床试验技术指导原则(试行) | 2024/12/31 |
| 72 | 2024 年第 59 号 | 预防用猴痘疫苗临床试验技术指导原则(试行) | 2024/12/31 |
| 73 | 2024 年第 60 号 | 脑膜炎球菌疫苗临床试验技术指导原则(试行) | 2024/12/31 |
附件 9 2024 年药审中心开展的培训
| 序号 | 培训时间 | 期数 | 培训内容 | 参加人数 |
|---|---|---|---|---|
| 1 | 2024 年 1 月 8 日 | 药审云课堂第一期 | 一般性技术问题咨询总体情况介绍 | 10000 余人 |
| 化学仿制药一般性技术问题咨询分析 | ||||
| 受理相关一般性技术问题咨询 | ||||
| 申报资料接收与管理相关一般性技术问题 | ||||
| 2 | 2024 年 2 月 2 日 | 药审云课堂第二期 | 化药药学补充申请常见问题解析 | 10000 余人 |
| 临床试验期间生物制品药学研究和变更技术指导原则 | ||||
| 药品注册申请电子申报资料制作软件使用介绍 | ||||
| 药品注册申请电子申报的新要求介绍及常见问题解答 | ||||
| 药品注册申请电子申报资料接收有关要求及注意事项 | ||||
| 《M4 模块一行政文件和药品信息》基本要求及常见问题 | ||||
| 3 | 2024 年 3 月 1 日 | 药审云课堂第三期 | 化学仿制药原料药工艺研究常见问题分析 | 11000 余人 |
| 化学仿制药制剂处方工艺研究常见问题分析 | ||||
| 化学仿制药质量对比研究常见问题分析 | ||||
| 原料药工艺信息表核定要求与常见问题分析 | ||||
| 制剂工艺信息表核定要求与常见问题分析 | ||||
| 质量标准核定要求与常见问题分析 | ||||
| 《2023 年度药品审评报告》介绍 | ||||
| 4 | 2024 年 4 月 12 日 | 药审云课堂第四期 | 古代经典名方药学基本要求 | 11000 余人 |
| 关于加快古代经典名方中药复方制剂沟通交流和申报的有关措施 | ||||
| 化学仿制药注册受理基本要求及常见问题 | ||||
| 《化学药品 3 类注册申请药学自评估报告(原料药)(征求意见稿)》主要内容解读及填写说明 | ||||
| 《化学药品 3 类注册申请药学自评估报告(制剂)(征求意见稿)》主要内容解读及填写说明 | ||||
| 化学药物仿制药生物等效性研究审评要点 | ||||
| 生物等效性研究常见问题分析 | ||||
| 干细胞产品非临床研究技术指导原则 | ||||
| 5 | 2024 年 5 月 10 日 | 药审云课堂第五期 | 中药受理审查基本要求及常见问题 | 12000 余人 |
| 中药沟通交流临床方面资料要求 | ||||
| 已上市中药生产工艺变更技术要求及常见问题 | ||||
| 已上市中药说明书安全性内容修订 | ||||
| 罕见病酶替代疗法药物非临床研究指导原则解读 | ||||
| 改良型新药研发沟通交流中的临床关注点 | ||||
| 《药品注册研发生产主体规信息管理与审查指导原则(试行)》 | ||||
| 6 | 2024 年 6 月 7 日 | 药审云课堂第六期 | 已上市境外生产药品转移至境内生产的药品上市注册申请申报资料要求(化学药品)解读 | 7000 余人 |
| 生物制品受理审查基本要求及常见问题 | ||||
| 抗体类产品申报上市审评关注点和申报资料常见问题分析与建议 | ||||
| 新药临床研发常见问题 | ||||
| 药物免疫毒性非临床研究技术指导原则解读 | ||||
| 注册核查及检验过程中的共性问题 | ||||
| 7 | 2024 年 7 月 5 日 | 药审云课堂第七期 | 中药新药临床研究基本考虑 | 6900 余人 |
| 化学药及生物制品临床试验技术要求基本考虑 | ||||
| ICH M3(R2)指导原则及 Q&A | ||||
| 《药物临床试验适应性设计指导原则(试行)》 | ||||
| 《在罕见疾病药物临床研发中应用去中心化临床试验的技术指导原则》 | ||||
| 8 | 2024 年 8 月 2 日 | 药审云课堂第八期 | 电子申报资料网络传输介绍(2024 年 7 月 1 日发布) | 8000 余人 |
| 抗肿瘤药药学审评中的共性问题 | ||||
| ICH S6 生物制品的临床前安全性评价 | ||||
| 抗肿瘤药物临床审评中的共性问题 | ||||
| 创新药审评中临床药理常见问题和考虑 | ||||
| 治疗性蛋白药物药代动力学研究常见问题和考虑 | ||||
| 先进治疗药品药学审评常见问题及审评考虑 | ||||
| 9 | 2024 年 9 月 6日 | 药审云课堂第九期 | 局部起效化学仿制药体外释放(IVRT)与体外透皮(IVPT)研究的一般考虑 | 8000 余人 |
| 《已上市化学药品药学变更研究技术指导原则(试行)》原料药变更的问答 | ||||
| 药物上市后变更的非临床研究和评价关注点 | ||||
| 《已上市化学药品和生物制品临床变更技术指导原则》解读 | ||||
| 临床试验期间变更管理及药物临床试验期间方案变更的思考 | ||||
| 《药物临床试验不良事件相关性评价技术指导原则》起草背景及主要内容简介 | ||||
| 10 | 2024 年 10 月 11日 | 药审云课堂第十期 | 以患者为中心审评考虑与基本考虑介绍 | 8000 余人 |
| 以患者为中心的罕见疾病药物研发试点工作-“关爱计划”的介绍与申报说明 | ||||
| 关于罕见病药物的非临床研究评价相关考虑 | ||||
| 药品注册申请电子申报常见问题解答 | ||||
| 药品注册核查检验工作的基本考虑 | ||||
| 《化学药品仿制药口服溶液剂药学研究技术指导原则》解读 | ||||
| 11 | 2024 年 11 月 8 日 | 药审云课堂第十一期 | EOP II 沟通交流环节药学专业主要考虑 | 9000 余人 |
| EOP II 沟通交流环节非临床技术审评考虑 | ||||
| 创新药 III 期确证性临床试验开展前沟通交流临床审评的关键考虑 | ||||
| 先进治疗药品确证性临床试验开展前沟通交流技术审评考虑要点 | ||||
| 《抗肿瘤药物临床试验中 SUSAR 分析与处理技术指导原则》解读 | ||||
| 12 | 2024 年 12 月 6 日 | 药审云课堂第十二期 | 化学药品仿制药药学申报资料撰写要求及常见问题(原料药一) | 11000 余人 |
| 化学药品仿制药药学申报资料撰写要求及常见问题(原料药二) | ||||
| 化学药品仿制药药学申报资料撰写要求及常见问题(制剂一) | ||||
| 化学药品仿制药药学申报资料撰写要求及常见问题(制剂二) |
线下培训
| 序号 | 培训时间 | 培训主题 | 参加人数 |
| 1 | 2024 年 4 月 25 日 | 支持东北医药产业发展药品注册技术系列培训班 | 700 余人 |
| 2 | 2024 年 4 月 26 日 | 2024 年支持京津冀地区医药产业发展药品注册技术系列培训班(化学药专场) | 700 余人 |
| 3 | 2024 年 5 月 29 日 | 支持成渝医药产业发展药品注册技术系列培训班(中药、化药专场) | 920 余人 |
| 4 | 2024 年 7 月 11 日 | 2024 年支持京津冀地区医药产业发展药品注册技术系列培训班(生物制品专场) | 400 余人 |
| 5 | 2024 年 7 月 25 日 | 支持长三角和大湾区医药产业发展药品注册技术系列培训班 | 1000 余人 |
| 6 | 2024 年 9 月 12 日 | 支持长三角和大湾区医药产业发展药品注册技术系列培训班(中药专场) | 1000 余人 |
| 7 | 2024 年 10 月 17 日 | 支持京津冀地区医药产业发展药品注册技术系列培训班(中药注册研发专题培训) | 350 余人 |
| 8 | 2024 年 10 月 24 日 | 支持川渝地区医药产业发展药品注册技术系列培训班(生物制品、放射药) | 1000 余人 |
| 9 | 2024 年 11 月 19 日 | 支持长三角和大湾区医药产业发展药品注册技术系列培训班(细胞和基因治疗)在沪举办 | 700 余人 |
| 10 | 2024 年 11 月 25 日 | 省局药品上市后变更技术要求培训 | 500 余人 |











































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论