1.4.1 本周全球TOP10创新药研发进展
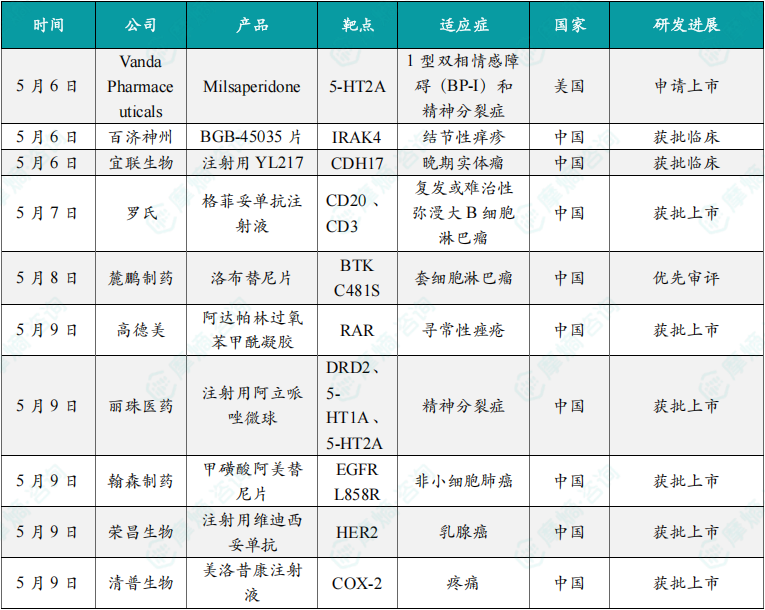
(1)Vanda Pharmaceuticals在研药物Milsaperidone在美国申请上市
5月6日,Vanda Pharmaceuticals宣布,美国FDA已受理其为在研疗法Bysanti(milsaperidone)递交的新药申请(NDA),用于治疗1型双相情感障碍(BP-I)和精神分裂症。FDA预计在2026年2月21日前完成审评。Bysanti是一种新化学实体。Vanda发现,经口服给药后,milsaperidone可迅速转化为iloperidone(一种已上市抗精神病药物)。临床研究显示,在低剂量和高剂量下,无论是单次给药还是多次给药,milsaperidone与iloperidone的生物等效性均已被证实。Bysanti属于非典型抗精神病药物类别,显示出对α1肾上腺素能受体的高亲和力,同时也作用于某些5-羟色胺和多巴胺受体,这些受体被认为与其治疗效应密切相关。
(2)百济神州1类新药BGB-45035片获批临床
5月6日,中国国家药监局药品审评中心(CDE)官网公示,百济神州申报的1类新药BGB-45035片就新适应症获得临床试验默示许可,拟开发治疗结节性痒疹。BGB-45035片是一款靶向IRAK4的蛋白降解剂(IRAK4 CDAC),该产品此前于2024年8月首次在中国获批IND,用于治疗中重度特应性皮炎。IRAK4是一种支架激酶,处于先天性免疫反应与适应性免疫反应的交汇点,通过其激酶活性和支架功能执行多重作用。有研究表明,IRAK4是Toll样受体(TLRs)和IL-1受体介导的炎症发生中的关键性蛋白。据百济神州公开资料介绍,BGB-45035具有多个优势,有希望开发成为“best-in-class”药物:IRAK4降解更快更深层次,对细胞因子抑制更强,在多种细胞类型中实现了更完全的IRAK4降解;在疾病模型中药效更好;无心血管风险。
(3)宜联生物1类新药注射用YL217获批临床
5月6日,CDE官网显示,宜联生物注射用YL217获批临床,拟用于经病理学确诊的晚期实体瘤,包括胃肠道、食管、胃食管结合部、胰腺或壶腹部腺癌和神经内分泌肿瘤等。据公开资料,这是该药首次在国内获批临床。YL217是一款靶向CDH17的ADC,可在肿瘤细胞和肿瘤微环境中释放有效载荷。YL217在CDH17高表达或低表达的体外、体内模型中均表现出优异的肿瘤杀伤效果和良好的耐受性。非人灵长类动物毒理研究显示YL217具有良好的安全性。临床前研究数据支持YL217在胃肠道肿瘤患者中进一步开发。
(4)罗氏双特异性抗体格菲妥单抗在中国获批新适应症
5月7日,罗氏(Roche)宣布格菲妥单抗注射液新适应症上市申请已获得中国国家药监局(NMPA)批准,联合吉西他滨与奥沙利铂(GemOx)用于治疗不适合自体造血干细胞移植(ASCT)的复发或难治性弥漫大B细胞淋巴瘤非特指型(DLBCL NOS)成人患者(2L+ DLBCL)。格菲妥单抗(glofitamab,商品名:Columvi)是一款靶向CD20和CD3的双特异性T细胞衔接蛋白。格菲妥单抗是一类无需定制化的即用型T细胞疗法,依托新型的2:1双抗结构,可同时靶向结合2种抗原分子——T细胞表面的CD3抗原和B细胞表面的CD20抗原,激活、扩增、重定向T细胞的同时,可带来更强的B细胞抓取能力和作用效力,在安全耐受的前提下加强杀伤肿瘤细胞的能力。因此,这一疗法可以帮助患者获得早期、深度的缓解,减小疾病进展风险。
(5)麓鹏制药的洛布替尼片拟纳入优先审评
5月8日,中国国家药监局药品审评中心(CDE)官网公示,麓鹏制药申请的洛布替尼片拟纳入优先审评,适用于既往接受过布鲁顿氏酪氨酸激酶(BTK)抑制剂治疗的成人套细胞淋巴瘤(MCL)患者。公开资料显示,这是麓鹏制药在研的第四代BTK抑制剂。洛布替尼(rocbrutinib,LP-168)是一款共价兼非共价BTK抑制剂,该产品具有独特的双结合模式:与野生型BTK的共价结合和与突变BTK的可逆结合。其不仅能克服第1/2/3代BTK抑制剂的耐药,而且在活性、选择性和药代动力学(PK)方面都有提高。该药正在开展的临床适应症包括各类B细胞淋巴瘤,主要有MCL、慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)、边缘区淋巴瘤(MZL)和弥漫大B细胞淋巴瘤(DLBCL)等。
(6)高德美公司的抗痤疮新药阿达帕林过氧苯甲酰凝胶在中国获批上市
5月9日,中国国家药监局(NMPA)官网发布的批件信息显示,高德美(Galderma)公司的阿达帕林过氧苯甲酰凝胶上市申请已获得批准。公开资料显示,这是一款每日一次的处方药(英文商品名:Epiduo),已经获美国FDA批准用于治疗寻常性痤疮。本次在中国获批产品为阿达帕林过氧苯甲酰凝胶(0.3%/2.5%),它结合了两种有效的药物来治疗顽固的痤疮,并通过畅通毛孔和杀死细菌来防止痤疮的形成。其中,阿达帕林为第3代维A酸药物。维A酸类药物具有改善毛囊皮脂腺导管口角化、溶解微粉刺和粉刺、抗炎、预防和改善痤疮炎症后色素沉着和痤疮瘢痕等作用,它还能增加皮肤渗透性,在联合治疗中可以增加外用抗菌及抗炎药物的疗效。过氧苯甲酰是一种抗氧化剂,可缓慢释放新生态氧和苯甲酸,具有杀灭痤疮丙酸杆菌、抗炎及轻度溶解粉刺作用。过氧苯甲酰可单独使用,也可联合外用维A酸类药物或外用抗生素使用。
(7)丽珠医药抗精神病药物注射用阿立哌唑微球获批上市
5月9日,中国国家药监局(NMPA)官网发布的批件信息显示,丽珠医药全资附属公司丽珠微球申报的改良型新药注射用阿立哌唑微球已获批上市。根据丽珠医药早先公告介绍,这是丽珠微球自主开发的一款阿立哌唑的长效缓释微球制剂,每月给药一次,适用于成人精神分裂症。 阿立哌唑是一种新型的非典型抗精神病药物,主要用于治疗精神分裂症等精神疾病。它是D2受体和5-HT1A受体的部分激动剂,也是5-HT2A受体的拮抗剂,具有副作用小、疗效显著、复发率低等优点,适用于精神分裂症患者的全病程长期治疗。,本次获批的这款注射用阿立哌唑微球是阿立哌唑的长效缓释微球制剂,每月注射1次。对于常见的精神分裂症患者反感服药的问题,长效注射剂可使血药浓度更平稳,减少给药次数,提高用药依从性,避免漏药藏药,降低复发风险,减轻痛苦且维持病情稳定。
(8)翰森制药肺癌新药阿美替尼获批新适应症
5月9日,中国国家药监局(NMPA)官网发布的批件信息显示,翰森制药三代EGFR-TKI甲磺酸阿美替尼片的新适应症上市申请获得批准。该药本次获批的适应症为:用于具有表皮生长因素受体(EGFR)外显子19缺失或外显子21(L858R)置换突变阳性的非小细胞肺癌(NSCLC)成人患者肿瘤切除术后的辅助治疗。这也是阿美替尼在中国获批的第四项适应症。阿美替尼是一款三代EGFR-TKI。2020年3月,该产品获批用于既往经EGFR-TKI治疗进展,且T790M突变阳性的局部晚期或转移性NSCLC患者;2021年12月,该产品获批一线治疗具有EGFR外显子19缺失或外显子21(L858R)置换突变阳性的局部晚期或转移性NSCLC成人患者;2024年3月,该产品获批用于含铂根治性放化疗后未出现疾病进展的不可切除的局部晚期EGFR外显子19缺失或外显子21(L858R)置换突变的NSCLC患者治疗。
(9)荣昌生物的维迪西妥单抗获批新适应症,针对乳腺癌
5月9日,中国国家药监局(NMPA)官网发布的批件信息显示,荣昌生物的靶向HER2的抗体偶联药物(ADC)注射用维迪西妥单抗一项新适应症上市申请获得批准。根据NMPA优先审评公示可知,该药本次获批适用于既往接受过曲妥珠单抗或其生物类似物和紫杉类药物治疗的HER2阳性(HER2免疫组织化学检查结果为3+或FISH+)存在肝转移的晚期乳腺癌患者。这也是该产品在中国获批的第三项适应症。维迪西妥单抗(RC48)是荣昌生物研发的靶向HER2的ADC,此前已有胃癌、尿路上皮癌两大适应症在中国获批上市。
(10)南京清普生物的长效镇痛新药美洛昔康注射液获批上市
5月9日,国家药监局网站显示,南京清普生物的美洛昔康注射液(QP001)获批上市。QP001是目前国内唯一注册分类为国家2类新药的美洛昔康注射液。作为一种选择性环氧合酶-2(COX-2)抑制剂,QP001能够阻断引发身体疼痛和炎症的COX-2的释放,同时对环氧合酶-1(COX-1)影响较小,从而减轻胃肠道、血小板抑制等副作用。当前,临床常用于术后镇痛的注射药物半衰期普遍偏短,往往需要一日多次注射或通过留置导管持续给药。QP001的半衰期长达18~22小时,24小时的长效镇痛特性有望突破传统给药间隙的镇痛瓶颈,缓解夜间疼痛发作,进而改善患者治疗依从性。
1.4.2 本周全球TOP10积极/失败临床结果
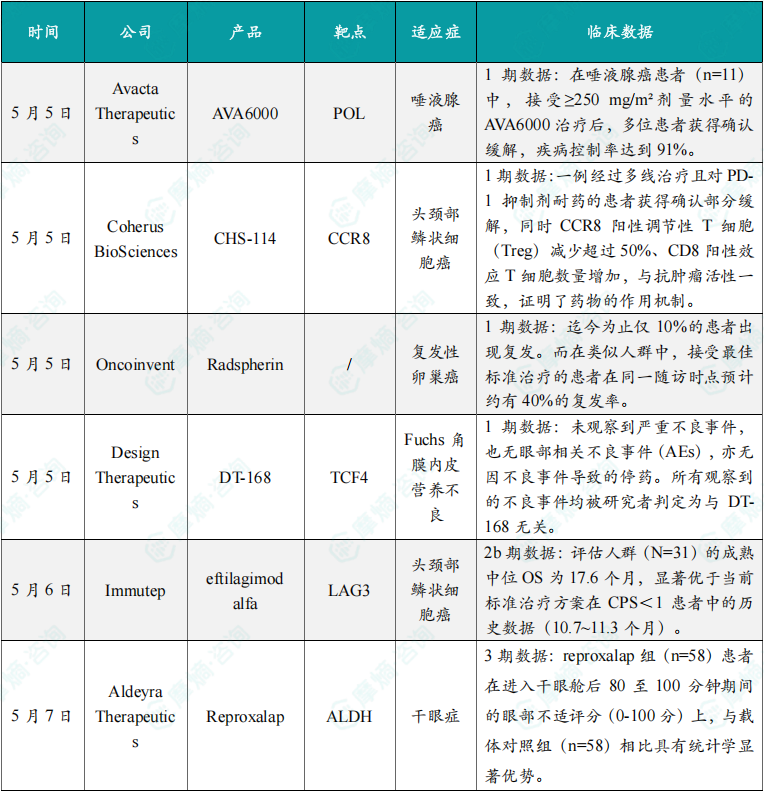
(1)Avacta Therapeutics公司公布AVA6000 1期临床积极结果
5月5日,Avacta Therapeutics公司日前公布了其主打在研多肽偶联药物AVA6000的1期临床试验积极数据。AVA6000是一种在肿瘤微环境中特异性激活的多柔比星(doxorubicin)前药,旨在减少传统化疗的全身性副作用。在1a期剂量递增研究中,无论是每三周一次(Q3W)还是每两周一次(Q2W)的给药方案,AVA6000均显示出良好的耐受性。即使剂量升高至每三周385 mg/m²,也未达到最大耐受剂量(MTD)。在唾液腺癌患者(n=11)中,接受≥250 mg/m²剂量水平的AVA6000治疗后,多位患者获得确认缓解,疾病控制率达到91%。中位无进展生存期(PFS)尚未达到,当前中位随访时间已超过25周。AVA6000是Avacta研发管线中的首个多肽偶联药物,由多柔比星与Avacta专有的pre|CISION多肽偶联而成,该多肽可在肿瘤微环境中由成纤维细胞激活蛋白-α(FAP)特异性切割。FAP在大多数实体瘤中,与健康组织相比表达水平显著升高。Avacta的多肽偶联药物利用这一特征在肿瘤微环境中特异性释放活性药物,从而降低系统暴露和毒性,为患者提供更好的治疗效果。
(2)Coherus BioSciences公司在研药物CHS-114 1期临床结果积极
5月5日,Coherus BioSciences公布了其正在进行的1期临床试验的更新数据,该试验旨在评估选择性抗CCR8抗体CHS-114作为单药,以及与toripalimab联用,治疗复发/转移性头颈部鳞状细胞癌(HNSCC)患者的活性,以优化给药方案。数据显示,一例经过多线治疗且对PD-1抑制剂耐药的患者获得确认部分缓解,同时CCR8阳性调节性T细胞(Treg)减少超过50%、CD8阳性效应T细胞数量增加,与抗肿瘤活性一致,证明了药物的作用机制。这些数据支持继续评估CHS-114与包括toripalimab在内的其他疗法联用,并支持推进该研究第3部分的患者招募与开展,以进一步评估CHS-114与toripalimab在HNSCC中的疗效。CHS-114是一种去岩藻糖化的CCR8单克隆抗体,能优先杀伤肿瘤微环境中的CCR8阳性Treg,同时保留正常组织中的CD8阳性效应T细胞和Treg。
(3)Oncoinvent公司公布Radspherin 1期临床试验18个月随访结果
5月5日,Oncoinvent公布了其1期临床试验RAD-18-001的18个月随访结果。该试验在铂敏感复发性卵巢癌合并腹膜癌转移患者中评估放射性疗法Radspherin的效果,该试验于2023年底完成患者招募,目前患者正接受长期随访。在本试验中,10例患者接受了单次腹腔内Radspherin给药。Oncoinvent在2024年11月公布的12个月数据中,10例患者中仅1例出现腹膜复发。18个月随访时,未见新增复发病例,即迄今为止仅10%的患者出现复发。而在类似人群中,接受最佳标准治疗的患者在同一随访时点预计约有40%的复发率。Radspherin是一种在研放射性药物,旨在局部治疗已扩散至体腔的癌症。它由数十亿个含放射性同位素镭-224的碳酸钙微粒组成。其作用机制是镭-224衰变发射的α粒子,这是一种高效能的电离辐射形式。Radspherin用于治疗卵巢癌和结直肠癌引起的腹膜癌转移,在外科切除所有可见肿瘤后,通过腹腔内给药。
(4)Design Therapeutics公司公布在研药物DT-168 1期临床试验积极结果
5月5日,Design Therapeutics公司公布了在研药物DT-168在健康志愿者中开展的1期单次及多次递增剂量(SAD/MAD)试验的积极数据。DT-168是一种新型GeneTAC小分子药物,制剂为滴眼液,旨在选择性靶向并降低导致角膜内皮细胞功能障碍的突变TCF4基因的表达,从而治疗Fuchs角膜内皮营养不良(FECD)。这项试验旨在评估DT-168滴眼液的安全性、耐受性和系统药代动力学(PK)。试验结果显示,DT-168滴眼液在所有受试者中均耐受良好。未观察到严重不良事件,也无眼部相关不良事件(AEs),亦无因不良事件导致的停药。所有观察到的不良事件均被研究者判定为与DT-168无关。PK分析结果表明,在所有时间点和所有剂量组中,受试者的系统性暴露均低于定量检测的下限。
(5)Immutep公司在研药物eftilagimod alfa组合疗法 2b期临床试验取得积极结果
5月6日,Immutep公司宣布,其2b期临床试验TACTI-003(KEYNOTE-C34)患者队列B取得积极结果:中位总生存期(OS)达17.6个月。该队列旨在评估eftilagimod alfa(efti)联合默沙东(MSD)的抗PD-1疗法Keytruda(pembrolizumab)作为复发/转移性头颈部鳞状细胞癌(HNSCC)患者一线治疗方案的效果,受试者为PD-L1表达综合阳性评分(CPS)低于1的人群。截至2025年3月31日,评估人群(N=31)的成熟中位OS为17.6个月,显著优于当前标准治疗方案在CPS<1患者中的历史数据(10.7~11.3个月)。LAG-3蛋白能够调控T淋巴细胞和抗原呈现细胞(APCs)的信号通路,在适应性免疫反应中起到重要作用。Efti是一种潜在“first-in-class”可溶性LAG-3融合蛋白。通过与APC表面的主要组织相容性复合体II(MHC II)相结合,能够激活APCs,这会激活和增殖CD8阳性细胞毒性T细胞、CD4阳性辅助性T细胞、树突状细胞、NK细胞和单核细胞,提升患者对癌症抗原的免疫反应。
(6)Aldeyra Therapeutics公司在研疗法reproxalap达3期临床主要终点
5月7日,Aldeyra Therapeutics宣布,在研疗法reproxalap在治疗干眼症的一项3期随机、双盲、载体对照干眼舱试验中达到预设主要终点。数据显示,在眼部不适症状方面,reproxalap组(n=58)患者在进入干眼舱后80至100分钟期间的眼部不适评分(0 100分)上,与载体对照组(n=58)相比具有统计学显著优势(最小二乘均值差为-6.5;95% CI: 10.5, 2.5,P=0.002)。Reproxalap是一款潜在“first-in-class”的在研小分子活性醛抑制剂。活性醛含量会在眼部或系统性发炎时上升,造成眼睛发炎、泪水分泌降低、眼睛发红以及改变泪水内脂质组成,许多干眼症患者具有较高的活性醛水平。Reproxalap通过与活性醛共价结合,防止它们与蛋白产生相互作用,从而降低眼部的炎症。
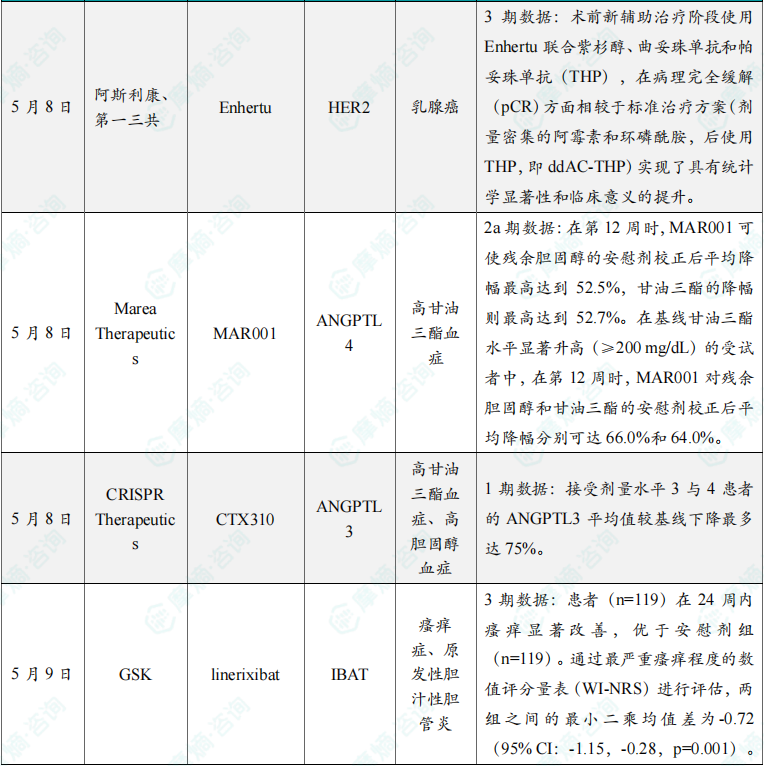
(7)阿斯利康与第一三共开发的Enhertu在DESTINY-Breast11临床3期试验中取得积极结果
5月8日,阿斯利康(AstraZeneca)与第一三共(Daiichi Sankyo)宣布,双方联合开发的重磅抗体偶联药物Enhertu(trastuzumab deruxtecan)在DESTINY-Breast11临床3期试验当中取得积极结果。分析显示,在高风险、局部晚期HER2阳性早期乳腺癌患者中,于术前新辅助治疗阶段使用Enhertu联合紫杉醇、曲妥珠单抗和帕妥珠单抗(THP),在病理完全缓解(pCR)方面相较于标准治疗方案(剂量密集的阿霉素和环磷酰胺,后使用THP,即ddAC-THP)实现了具有统计学显著性和临床意义的提升。病理完全缓解被定义为治疗后在切除的乳腺组织和淋巴结中未发现浸润性癌细胞。根据新闻稿,这是首个3期临床试验证实Enhertu在早期乳腺癌中具有治疗益处。Enhertu是阿斯利康和第一三共联合开发的ADC疗法。它采用第一三共专有的DXd ADC技术平台设计,由靶向HER2的人源化单克隆抗体通过四肽可裂解连接子,与拓扑异构酶1抑制剂有效载荷连接组成。
(8)Marea Therapeuticsnhertu公布MAR001 2a期临床试验积极结果
5月8日,Marea Therapeutics公司在欧洲动脉粥样硬化学会(EAS)年会上,公布了其在研、潜在“first-in-class”的ANGPTL4靶向单抗MAR001在2a期临床试验中的亮眼数据。这项随机、双盲、安慰剂对照2a期试验的主要目的是评估MAR001在高甘油三酯及高残余胆固醇患者中多次给药的安全性与耐受性。结果显示,在第12周时,MAR001可使残余胆固醇的安慰剂校正后平均降幅最高达到52.5%,甘油三酯的降幅则最高达到52.7%。在基线甘油三酯水平显著升高(≥200 mg/dL)的受试者中,在第12周时,MAR001对残余胆固醇和甘油三酯的安慰剂校正后平均降幅分别可达66.0%和64.0%。MAR001同时展现良好的耐受性。
(9)CRISPR Therapeutics公布CTX310 1期临床试验积极结果
5月8日,CRISPR Therapeutics公布其在研、ANGPTL3靶向体内肝脏基因编辑疗法CTX310,在其首个人体剂量递增临床1期试验的积极结果。该研究共纳入四类血脂异常患者群体,包括纯合子家族性高胆固醇血症(HoFH)、严重高甘油三酯血症(sHTG)、杂合子家族性高胆固醇血症(HeFH)及混合型血脂异常(MDL)患者。截至2025年4月16日,已有来自四个剂量组的10名患者完成至少30天随访。结果显示,单次给药后,CTX310可实现剂量依赖性地降低患者的ANGPTL3、甘油三酯(TG)和低密度脂蛋白胆固醇(LDL-C)水平。研究数据显示,接受剂量水平3与4患者的ANGPTL3平均值较基线下降最多达75%。CTX310在各剂量水平下均具有良好的耐受性,未观察到与治疗相关的严重不良事件,也无3级及以上不良事件发生。在肝功能相关指标及血小板计数方面,未见临床意义上的变化或剂量依赖性趋势。
(10)GSK小分子药物linerixibat达到3期临床主要终点
5月9日,GSK公司宣布,3期临床试验GLISTEN取得积极结果。该试验评估了在患有胆汁淤积性瘙痒症和原发性胆汁性胆管炎(PBC)成年患者中,靶向回肠胆汁酸转运蛋白(IBAT)的在研药物linerixibat的疗效。GLISTEN试验达到主要终点,结果显示,接受linerixibat治疗的患者(n=119)在24周内瘙痒显著改善,优于安慰剂组(n=119)。通过最严重瘙痒程度的数值评分量表(WI-NRS)进行评估,两组之间的最小二乘均值差为-0.72(95% CI:-1.15,-0.28,p=0.001)。该结果显示,linerixibat有望缓解PBC患者的一项主要症状——顽固性瘙痒。
同期事件:
1. 2025年第19周05.05-05.11国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第19周05.05-05.11国内仿制药/生物类似物申报/审批数据分析
3. 2025年第19周05.05-05.11国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.05.05-2025.05.11) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询yl23455永利官网(原药融云)数据库(vip.sdbaichao.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!













































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论