1.4.1本周全球创新药研发概览
(1)本周全球TOP10创新药研发进展
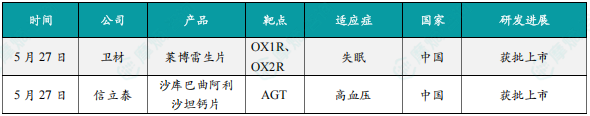
1.卫材失眠新药莱博雷生在中国获批上市
5月27日,卫材(Eisai)宣布莱博雷生片的上市申请已获得中国国家药监局(NMPA)批准。莱博雷生片(lemborexant)是一款双重食欲素受体拮抗剂,此前已经在中国香港地区获批上市,用于治疗成人失眠,特别是入睡困难和/或睡眠维持困难。莱博雷生通过竞争性结合两种食欲素受体亚型(OX1R和OX2R)精准调节食欲素系统,通过抑制食欲素的促觉醒作用,诱导睡眠。莱博雷生可缩短入睡时间、减少夜间觉醒时间、延长总睡眠时间,并且,不同于传统的GABA-A促眠药抑制REM期,其可同时延长非快速眼动期(NREM)和快速眼动睡眠(REM),有助于正向调节睡眠结构,使其更接近生理性睡眠。
2. 信立泰高血压1类新药沙库巴曲阿利沙坦钙片在中国获批上市
5月27日,中国国家药监局(NMPA)官网发布的批件信息显示,信立泰1类新药沙库巴曲阿利沙坦钙片(S086)的上市申请已获得批准。S086是一种血管紧张素II受体-脑啡肽酶双重抑制剂(ARNi),目标适应症为高血压和慢性心衰。根据信立泰此前公告可知,该药本次获批的适应症为治疗轻、中度原发性高血压。沙库巴曲阿利沙坦钙片为一种血管紧张素II受体-脑啡肽酶双重抑制剂(ARNi),其药物相互作用风险小,安全性好,对心、肾等靶器官均有保护作用。研究显示,ARNi类药物在抑制脑啡肽酶的同时可阻滞血管紧张素II1型受体(AT1),以增加循环中利钠肽的水平,进而发挥其促尿钠排泄、利尿、舒张血管、降低交感神经张力、抗细胞增殖、抗心肌肥厚及调节代谢作用。同时,AT1阻滞可以减弱血管收缩、减少水钠潴留、抑制心肌肥厚和抑制心血管阻止不良重构作用。
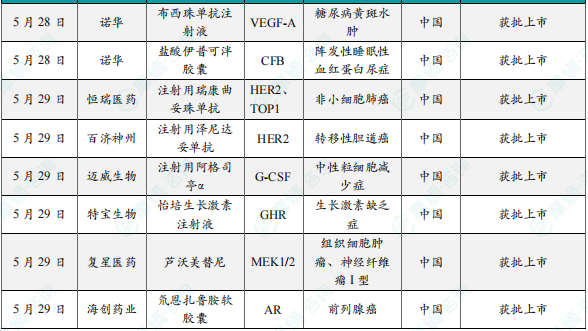
3.诺华眼科新药布西珠单抗在中国获批上市
5月28日,诺华(Novartis)宣布新一代抗血管内皮生长因子(anti-VEGF)单抗布西珠单抗注射液(brolucizumab)获中国国家药品监督管理局(NMPA)批准,用于治疗糖尿病黄斑水肿(DME)适应症。作为一款用于眼科的人源化单链抗体(scFv)药物,布西珠单抗凭借其超小分子(26kDa)、高浓度创新优势,精准靶向抑制血管内皮生长因子-A(VEGF-A),相比于上一代产品实现强效控制积液、延长治疗间隔等治疗突破。布西珠单抗可在负荷期后每三个月注射一次。该药此前已在美国获批用于治疗DME,在欧盟获批用于治疗湿性年龄相关性黄斑变性(wAMD),并获批优先在中国粤港澳大湾区的医疗机构内进行临床急需使用。根据诺华新闻稿介绍,DME治疗应快速消退水肿并维持长期视力改善。布西珠单抗的超小分子单链抗体结构,赋予其快速穿透视网膜各层的能力,快速抵达病灶深层,是一款负荷期6周间隔的抗VEGF制剂。
4. 诺华新药伊普可泮在中国获批新适应症,针对阵发性睡眠性血红蛋白尿症
5月29日,诺华中国宣布其口服单药疗法盐酸伊普可泮胶囊获得中国国家药品监督管理局(NMPA)批准新增适应症,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成人患者。本次适应症的拓展覆盖了已经接受过补体抑制剂治疗的PNH患者,为这一群体提供了新的治疗选择。作为特异性补体B因子口服抑制剂,伊普可泮在中国获批的适应症增至三项,包括既往未接受过补体抑制剂治疗的PNH成人患者和成人C3肾小球病(C3G)。PNH是一种慢性、进行性、危及生命的血液系统罕见疾病,临床主要表现为血管内溶血、骨髓衰竭和高风险并发血栓等。伊普可泮是一种口服的、补体旁路途径的B因子抑制剂,选择性抑制补体上游的旁路途径,可全面控制血管内溶血和血管外溶血,弥补抗补体C5治疗的缺陷,其通过口服方式用药,能够帮助患者在改善PNH症状的同时,更好地融入社会和家庭。这款产品曾被行业媒体Evaluate列为10款值得关注的潜在重磅疗法之一。
5.恒瑞医药1类新药瑞康曲妥珠单抗在中国获批上市
5月29日,中国国家药监局(NMPA)官网公示,恒瑞医药1类新药注射用瑞康曲妥珠单抗的上市申请已获得批准。该项上市申请此前已经被中国国家药监局药品审评中心(CDE)纳入优先审评,适应症为:单药适用于治疗存在HER2(ERBB2)激活突变且既往接受过至少一种系统治疗的不可切除的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。在晚期NSCLC患者中,约2~4%携带HER2激活突变,这些突变会导致HER2蛋白过度表达和过度激活,进而引发细胞异常增殖、抑制细胞死亡以及促进肿瘤生长和扩散。注射用瑞康曲妥珠单抗(研发代号:SHR-A1811)是恒瑞医药自主研发的以HER2为靶点的抗体药物偶联物(ADC)。它可特异性结合肿瘤细胞表面上的HER2,通过组织蛋白酶水解释放游离毒素,从而抑制DNA拓扑异构酶I的活性,最终诱导肿瘤细胞的凋亡。由于其高透膜性,还存在较强的旁路杀伤效应。
6.百济神州HER2双抗泽尼达妥单抗在中国获批上市
5月29日,中国国家药监局(NMPA)官网公示,百济神州申报的1类新药注射用泽尼达妥单抗上市申请已经获得批准,适用于既往接受过全身治疗的HER2高表达(IHC3+)的不可切除局部晚期或转移性胆道癌患者。泽尼达妥单抗(zanidatamab,ZW25)是一种HER2靶向双特异性抗体,可以同时结合两个非重叠的HER2表位。百济神州在2018年与Zymeworks公司达成一项高达约4.3亿美元的授权合作,获得这款产品在亚洲(日本除外)、澳大利亚和新西兰的独家授权。泽尼达妥单抗可以同时结合两个非重叠的HER2表位。这种独特的设计和增强的结合引发多种作用机制,包括HER2和HER3信号抑制,以及从细胞表面去除HER2蛋白和增强免疫效应功能,如补体依赖性细胞毒性(CDC),从而促进抗肿瘤活性。
7.迈威生物1类新药注射用阿格司亭α在中国获批上市
5月29日,中国国家药监局(NMPA)官网公示,迈威生物全资子公司泰康生物申报的1类新药注射用阿格司亭α(注射用重组[酵母分泌型]人血清白蛋白-人粒细胞集落刺激因子(I)融合蛋白,研发代号:8MW0511)上市申请获得批准,适用于成年非髓性恶性肿瘤患者在接受容易引起发热性中性粒细胞减少症的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染发生率。8MW0511属于新一代长效粒细胞集落刺激因子(G-CSF)(高活性改构细胞因子),应用基因融合技术将改构的G-CSF突变体基因的N端与人血清白蛋白的C端融合,可明显抑制G-CSF受体介导的清除途径,延长半衰期,在临床使用中可以降低给药频率,提高治疗的依从性。同时,8MW0511采用酵母表达系统进行生产,均一性较好;制备过程避免了复杂的PEG化学修饰反应,生产工艺简单、生产成本较低。
8. 特宝生物1类新药怡培生长激素注射液在中国获批上市
5月29日,中国国家药监局(NMPA)官网公示,特宝生物1类新药怡培生长激素注射液上市申请已获得批准。这是特宝生物自主研发的每周一次给药长效人生长激素,适用于治疗3岁及以上儿童的生长激素缺乏症所致的生长缓慢。生长激素缺乏症(GHD)是一种严重的罕见病,以身材矮小和代谢并发症为特征。在GHD患者中,垂体不能产生足够的生长激素,这不仅严重影响孩童身高,而且对儿童的整体内分泌健康和发育也很重要,生长激素是目前公认的对小儿GHD有效的治疗方式之一。怡培生长激素注射液采用40kD Y型分支聚乙二醇(YPEG)分子对人生长激素(rhGH)进行单分子修饰,优选高生物学活性、非N-末端位点为主的修饰组分,在保证疗效的同时,旨在降低给药剂量,获得更佳的长期药物安全性。该产品的平均半衰期为65~120小时,支持每周一次给药。研究表明,PEG修饰的长效生长激素在血液中表现出更高的稳定性,并增强了对蛋白质水解降解的保护。它还具有在特定条件下减轻或完全避免免疫原性的潜力,并可能有助于降低毒性。
9.复星医药1类新药芦沃美替尼在中国获批上市
5月29日,中国国家药监局(NMPA)官网公示,复星医药1类新药芦沃美替尼(曾用名:复迈替尼)上市申请已获得批准,该药适用于朗格汉斯细胞组织细胞增生症(LCH)和组织细胞肿瘤成人患者;2岁及2岁以上伴有症状、无法手术的丛状神经纤维瘤(PN)的I型神经纤维瘤病(NF1)儿童及青少年患者。芦沃美替尼(FCN-159)是复星医药自主研发的新型小分子化学药物,为一款MEK1/2选择性抑制剂,可以抑制RAS通路异常引起的肿瘤增殖,拟主要用于晚期实体瘤、I型神经纤维瘤、树突状细胞和组织细胞肿瘤、低级别脑胶质瘤等的治疗。
10.海创药业1类氘代新药氘恩扎鲁胺软胶囊中国获批上市,用于治疗前列腺癌
5月29日,中国国家药品监督管理局(NMPA)官网公示,海创药业自主研发的1类新药氘恩扎鲁胺软胶囊获批上市,用于治疗接受醋酸阿比特龙及化疗后出现疾病进展,且既往未接受新型雄激素受体抑制剂的转移性去势抵抗性前列腺癌(mCRPC)成人患者。氘恩扎鲁胺软胶囊是第二代雄激素受体(AR)抑制剂。氘代,即用氘原子替代氢原子的过程,会引起化合物的结构和性质变化,从而优化药物分子的药代动力学并降低毒性。氘恩扎鲁胺正是海创药业研发的第二代雄激素受体(AR)拮抗剂恩扎卢胺的氘代药物。该产品能够竞争性抑制雄激素与AR结合,阻断AR信号通路的传递,抑制前列腺癌细胞增殖,诱导前列腺癌细胞凋亡。此外,氘代后的药物代谢减缓,活性药物的暴露量增加,临床拟用剂量为恩扎卢胺的一半,有望提高用药依从性。
(2)本周全球TOP10积极/失败临床结果
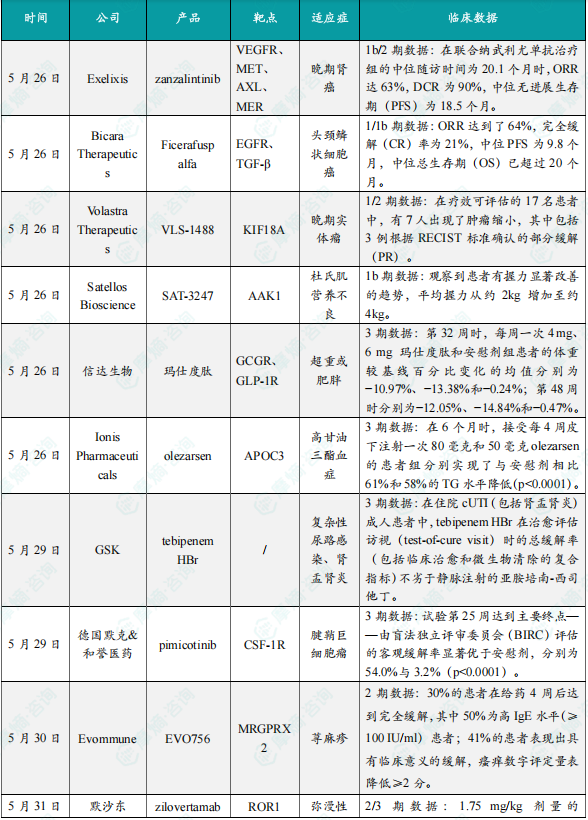

1.Exelixis公司公布zanzalintinib 1b/2期临床试验积极结果
5月26日,Exelixis公司公布了其1b/2期临床试验STELLAR-002的积极结果,该研究旨在评估zanzalintinib联合免疫检查点抑制剂用于初治晚期透明细胞肾细胞癌患者的治疗效果。Zanzalintinib是一种第三代口服酪氨酸激酶抑制剂,靶向VEGFR、MET、AXL和MER等与肿瘤发展、转移及耐药相关的关键通路。此次公布的结果显示,在zanzalintinib联合纳武利尤单抗治疗组的中位随访时间为20.1个月时,ORR达63%,DCR为90%,中位无进展生存期(PFS)为18.5个月。
2.Bicara Therapeutics公司公布ficerafusp alfa 1/1b期联合治疗试验数据
5月26日,Bicara Therapeutics公司公布了其候选双功能抗体ficerafusp alfa联合帕博利珠单抗一线治疗复发/转移性头颈鳞状细胞癌患者的1/1b期临床试验的新中期数据。Ficerafusp alfa是一种潜在“first-in-class”的双功能抗体,包括一个靶向EGFR的单克隆抗体和一个能够结合人类转化生长因子β(TGF-β)的结构域。通过这种靶向机制,ficerafusp alfa旨在逆转由TGF-β信号传导驱动的纤维化和免疫排除型肿瘤微环境,从而实现肿瘤穿透,促使深度且持久的治疗应答。截至2024年12月16日的数据,在PD-L1综合阳性评分(CPS)≥1、HPV阴性且疗效可评估的28例患者中,ORR达到了64%,完全缓解(CR)率为21%,中位PFS为9.8个月,中位总生存期(OS)已超过20个月。来自成对肿瘤活检的数据表明,治疗后磷酸化SMAD2表达显著下调,支持该药物靶向TGF-β通路的有效抑制作用。此外,安全性数据显示其副作用情况符合预期,并未发现新的安全问题。
3.Volastra Therapeutics公司公布VLS-1488 1/2期临床试验初步数据
5月26日,Volastra Therapeutics公司公布了其在研口服KIF18A抑制剂VLS-1488的1/2期临床试验的初步结果。VLS-1488是一种新型口服小分子KIF18A抑制剂,KIF18A是一种驱动蛋白,在癌细胞分裂过程中发挥关键作用,并且是染色体不稳定型癌症中的合成致死靶点。截至2025年1月10日的数据,在剂量递增试验中共纳入52名晚期实体瘤患者。在20名患有晚期高级别浆液性卵巢癌的患者中,大多数为铂类耐药且经过大量前期治疗,平均接受过5线治疗。在疗效可评估的17名患者中,有7人出现了肿瘤缩小,其中包括3例根据RECIST标准确认的部分缓解(PR),另有5名患者仍在继续接受治疗。安全性方面,未发现剂量限制性毒性,仅出现少数3级治疗相关不良事件(TRAE),无高于3级的严重TRAE。
4.Satellos Bioscience公司公布SAT-3247 1b期临床试验数据
5月26日,Satellos Bioscience公司公布了一项针对成年杜氏肌营养不良(DMD)男性患者的1b期临床试验的积极数据。该研究中使用的SAT-3247是一种口服小分子药物,正在开发作为一种新型治疗方法,用于在DMD和其他退行性或损伤情况下丢失骨骼肌的再生。该研究治疗了5名20至27岁的成年男性DMD患者。此次公布的结果显示,SAT-3247具有良好的安全性和耐受性。在同时使用类固醇的DMD患者中,其药代动力学(PK)表现与预期一致。观察到患者有握力显著改善的趋势,平均握力从约2 kg增加至约4 kg。研究结束后,受试者可选择进入11个月的长期随访。基于当前结果,Satellos计划推进该药物进入安慰剂对照的2期临床试验,以进一步评估其疗效与安全性。
5.信达生物公布减重降糖药玛仕度肽3期临床试验积极数据
5月26日,信达生物宣布,其GCG/GLP-1双受体激动剂玛仕度肽在中国超重或肥胖受试者中的3期临床研究GLORY-1的结果已在《新英格兰医学杂志》(NEJM)上发表。此次公布的结果显示,各剂量的玛仕度肽相较安慰剂均可显著降低体重。第32周时,每周一次4 mg、6 mg玛仕度肽和安慰剂组患者的体重较基线百分比变化的均值分别为−10.97%、−13.38%和−0.24%;第48周时分别为−12.05%、−14.84%和−0.47%。此外,玛仕度肽显著降低了患者的血压、血脂(甘油三酯、总胆固醇和LDL-C)、血尿酸、转氨酶水平等心血管代谢指标病,并显著降低了超重或肥胖受试者的肝脏脂肪含量。玛仕度肽总体耐受性和安全性良好,研究期间未见心血管风险增加的安全性信号。玛仕度肽是信达生物与礼来制药共同推进的一款胰高血糖素(GCG)/胰高血糖素样肽-1(GLP-1)双受体激动剂。作为一种哺乳动物胃泌酸调节素(OXM)类似物,玛仕度肽除了通过激动GLP-1受体促进胰岛素分泌、降低血糖和减轻体重外,还可通过激动GCGR增加能量消耗增强减重疗效,同时改善肝脏脂肪代谢。
6.Ionis Pharmaceuticals公布olezarsen 3期临床试验积极结果
5月26日,Ionis Pharmaceuticals公司宣布,其开发的“first-in-class”ASO疗法Tryngolza(olezarsen)在Essence临床3期研究中取得积极的顶线结果。该研究针对伴有或不伴有动脉粥样硬化性心血管疾病(ASCVD)风险的中度高甘油三酯(TG)血症患者。Olezarsen旨在抑制机体产生载脂蛋白C-III(apoC-III,一种在肝脏中产生的调节血液中TG代谢的蛋白)。美国FDA于2024年2月授予该疗法孤儿药资格和突破性疗法认定(BTD),并在12月批准其用于作为饮食控制的辅助治疗,以降低家族性乳糜微粒血症综合征成人患者的甘油三酯。此次公布的结果显示,试验达到其主要终点,在6个月时,接受每4周皮下注射一次80毫克和50毫克olezarsen的患者组分别实现了与安慰剂相比61%和58%的TG水平降低(p<0.0001)。Olezarsen还达到了研究中的所有关键次要终点。绝大多数参与者的TG水平降至<150 mg/dL,达到正常TG水平。
7.GSK开发的抗生素tebipenem HBr 3期临床试验达主要终点
5月29日,GSK与Spero Therapeutics宣布,其所开发的抗生素tebipenem HBr在关键3期PIVOT-PO临床试验中取得积极结果。基于该疗法用于治疗复杂性尿路感染(cUTI,包括肾盂肾炎)患者的中期分析疗效数据,独立数据监查委员会(IDMC)建议提前终止试验。GSK预计将在2025年下半年将试验结果递交给美国FDA,作为上市申请的一部分。此次试验结果包含入组的1690例患者的数据。分析显示,试验达到主要终点:在住院cUTI(包括肾盂肾炎)成人患者中,tebipenem HBr在治愈评估访视(test-of-cure visit)时的总缓解率(包括临床治愈和微生物清除的复合指标)不劣于静脉注射的亚胺培南-西司他丁。IDMC在审查过程中未发现该药物新的安全问题,最常见的不良事件为腹泻和头痛。
8.德国默克公司公布pimicotinib 3期临床试验积极结果
5月29日,德国默克(Merck KGaA)公布了MANEUVER临床3期试验第一部分的详细积极结果。该试验评估了由与和誉医药(Abbisko Therapeutics)联合开发的集落刺激因子-1受体(CSF-1R)抑制剂pimicotinib用于治疗腱鞘巨细胞瘤(TGCT)患者的疗效。分析显示,每日一次口服的pimicotinib在试验第25周达到主要终点——由盲法独立评审委员会(BIRC)评估的客观缓解率显著优于安慰剂,分别为54.0%与3.2%(p<0.0001)。研究还在所有与TGCT相关的关键患者报告结局的次要终点上显示出具有统计学意义且临床显著的改善。pimicotinib起效迅速,在13周时已有41.3%的患者(63人中的26人)达成客观缓解。在主要分析数据截止时,BIRC根据RECIST v1.1标准评估发现,几乎所有pimicotinib组患者(63人中的58人,92.1%)的肿瘤体积出现缩小,其中1人获得完全缓解,33人获得部分缓解。而针对TGCT专门设定的终点指标——肿瘤体积评分(TVS)显示,近三分之二接受pimicotinib治疗患者的肿瘤体积减少至少50%(pimicotinib组61.9% vs安慰剂组3.2%,p<0.0001)。
9.Evommune公布在研小分子EVO756 2期临床试验积极结果
5月30日,Evommune公布其潜在“first-in-class”在研小分子EVO756在成人慢性诱导性荨麻疹(CIndU)患者中的2期试验积极顶线数据。该数据支持EVO756在CIndU和特应性皮炎(AD)中2b期试验的持续开发。EVO756是一种强效、高选择性的MRGPRX2口服小分子拮抗剂,正在开发作为潜在“first-in-class”与潜在“best-in-class”口服疗法。这项多中心试验评估了EVO756在30名症状性皮肤划痕症(最常见的CIndU形式)患者中的安全性和有效性。疗效终点包括激发试验、瘙痒评分与基线相较的变化。患者接受每日一次300 mg或每日两次50 mg口服EVO756共四周,并在治疗期间进行每周访视以评估药物的安全性和有效性,患者作为自身的对照组。分析显示,EVO756在两个剂量组均显示出具有临床意义的缓解效果。30%的患者在给药4周后达到完全缓解,其中50%为高IgE水平(≥100 IU/ml)患者;41%的患者表现出具有临床意义的缓解,瘙痒数字评定量表降低≥2分。药物的总体耐受性良好,未出现严重治疗伴发不良事件(TEAEs),也无因不良事件导致的停药。
10.默沙东公布zilovertamab vedotin联合疗法 2/3期临床试验积极结果
5月31日,默沙东(MSD)公布了2/3期waveLINE-003研究的积极结果,该研究评估其在研抗体偶联药物(ADC)zilovertamab vedotin联合标准治疗利妥昔单抗和吉西他滨-奥沙利铂(R-GemOx)治疗复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的效果。在预设分析中,1.75 mg/kg剂量的zilovertamab vedotin联合R-GemOx在复发或难治性DLBCL患者(n=16)中实现了56.3%的客观缓解率(ORR),包括8例完全缓解(CR)和1例部分缓解(PR)。Zilovertamab vedotin是一种靶向受体酪氨酸激酶样孤儿受体1(ROR1)的潜在“first-in-class”抗体偶联药物。ROR1是一种在多种血液系统恶性肿瘤中过度表达的跨膜蛋白。该疗法目前正在3期waveLINE-010研究和2期waveLINE-007研究中评估用于初治DLBCL患者。此外,2期waveLINE-011研究也在近期启动,旨在评估该疗法联合利妥昔单抗和环磷酰胺、多柔比星及泼尼松(R-CHP)对比获批ADC疗法polatuzumab vedotin联合R-CHP治疗DLBCL患者的效果。
同期事件:
1. 2025年第22周05.26-06.01国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第22周05.26-06.01国内仿制药/生物类似物申报/审批数据分析
3. 2025年第22周05.26-06.01国内医药大健康行业政策法规汇总
以上内容均来自{ 摩熵咨询医药行业观察周报(2025.05.26-2025.06.01) },如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询yl23455永利官网(原药融云)数据库(vip.sdbaichao.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!













































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论