1.4.1 本周全球TOP10创新药研发进展
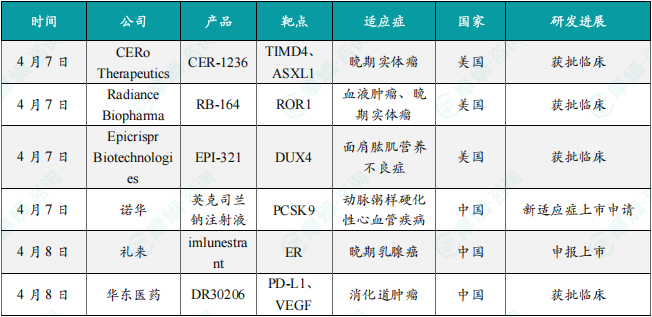
(1)CERo公司在研细胞疗法CER-1236在美国获批临床,针对晚期实体瘤
4月7日,CERo Therapeutics公司宣布,该公司为在研细胞疗法CER-1236递交的IND申请已获得美国FDA的许可,用于针对晚期实体瘤的1期临床试验,具体包括非小细胞肺癌和卵巢癌。CER-1236是首个以Tim-4L为靶点的CAR-T细胞疗法,也是首个通过改造T细胞,赋予其吞噬活性的疗法。临床前数据表明,这种双重机制可能有助于克服一直困扰实体瘤CAR-T细胞疗法的耐药障碍。据该公司介绍,CER-T细胞疗法能够增强机体去除感染、转化、恶性、凋亡、受损或坏死的细胞或颗粒的能力,以治疗各种癌症、急性和慢性感染、炎症、免疫和神经系统疾病。
(2)Radiance公司在研抗体偶联药物RB-164在美国获批临床,针对血液肿瘤及晚期实体瘤
4月7日,Radiance Biopharma宣布,该公司为在研抗体偶联药物(ADC)RB-164递交的IND申请已经获得美国FDA的许可。它是一种以ROR-1为靶点的ADC。该IND支持在美国启动RB-164的1期剂量递增及扩展临床试验,试验对象为ROR-1阳性的血液癌症及实体瘤患者。RB-164是一种新一代ADC,采用Fc静默单克隆抗体靶向ROR-1,并通过位点特异性偶联实现药物/抗体比例分布均一,从而改善药代动力学及毒理学特性,其药物载荷为MMAE。
(3)Epicrispr公司潜在“first-in-class”表观遗传学疗法在美国获批临床
4月7日,Epicrispr Biotechnologies宣布,在研疗法EPI-321的IND申请已获FDA的许可。EPI-321是一种潜在“first-in-class”的表观遗传学疗法,用于治疗面肩肱肌营养不良症(FSHD),这是一种遗传性神经肌肉疾病。该公司计划于2025年启动全球性1/2期临床试验。EPI-321是一种在研一次性基因调节疗法,旨在抑制DUX4的异常表达,DUX4是一种在FSHD中被错误激活并导致渐进性肌肉变性的基因。EPI-321通过临床验证的腺相关病毒(AAV)载体进行全身给药,在临床前模型中已证明它能有效抑制DUX4的表达并保护肌肉组织。EPI-321已获得FDA快速通道资格、罕见儿科疾病认定和孤儿药资格。
(4)诺华降脂疗法新适应症在中国申报上市,拟用于治疗动脉粥样硬化性心血管疾病
4月7日,中国国家药监局药品审评中心官网最新公示,诺华申报的英克司兰钠注射液新适应症上市申请获得受理。英克司兰钠是一款靶向PCSK9的小干扰核酸疗法,每年进行两次注射即可降低低密度脂蛋白胆固醇(LDL-C),是一款长效降脂siRNA疗法。根据诺华公开资料推测,本次该产品申请上市的适应症可能为治疗动脉粥样硬化性心血管疾病(ASCVD)患者或ASCVD高危人群。针对该适应症,英克司兰钠在全球范围内尚未获得监管机构批准。
(5)礼来1类新药在中国申报上市,针对晚期乳腺癌
4月8日,中国国家药监局药品审评中心(CDE)官网最新公示,礼来申报的1类新药imlunestrant片上市申请获得受理。公开资料显示,这是礼来在研的口服选择性雌激素受体降解剂(SERD)。该产品治疗雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)晚期乳腺癌患者的3期临床研究此前已经取得积极结果。Imlunestrant正是一款可穿越血脑屏障的小分子SERD药物。它的设计目标是无论ESR1突变状态如何,均能够在整个给药期间持续抑制ER靶点的活性。本次这款降解剂新药在中国申报上市,意味着其临床研发进程迎来新的进展。
(6)华东医药三特异性抗体新一项适应症获批临床,针对消化道肿瘤
4月8日,华东医药宣布其控股子公司道尔生物申报的注射用DR30206联合标准化疗用于晚期或转移性消化道肿瘤患者的临床试验申请获得批准,这是DR30206第二个获批的临床适应症,旨在评价DR30206联合标准化疗方案在消化道肿瘤中的安全性、耐受性和初步疗效。注射用DR30206是由道尔生物研发的1类治疗用生物制品,为一种靶向PD-L1、VEGF和TGF-β的抗体融合蛋白;通过阻断PD-1/PD-L1信号通路,恢复耗竭性CD8+T细胞的增殖;通过特异性结合游离VEGF和TGF-β,减少肿瘤新生血管的形成同时解除免疫抑制,从而达到治疗肿瘤的目的。公开资料显示,截至目前,全球尚无同时靶向PD-L1、VEGF和TGF-β 的抗体融合蛋白药物上市。此次注射用DR30206联合标准化疗用于晚期或转移性消化道肿瘤患者在中国的临床试验获批,是该款新药研发进程中的又一进展。
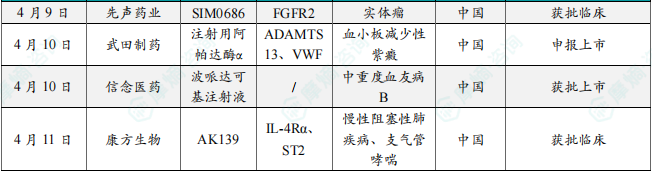
(7)先声药业抗体偶联药物在中国获批临床,针对晚期实体瘤
4月9日,中国国家药监局药品审评中心(CDE)官网最新公示,先声药业旗下先祥医药申报的1类新药注射用SIM0686获批临床,拟开发治疗FGFR2b阳性的局部晚期/转移性实体瘤。公开资料显示,这是一款靶向FGFR2b的抗体偶联药物(ADC),先声药业拟开发该产品治疗胃癌和肺癌等晚期恶性肿瘤。本次是该产品首次在中国获批IND。这是先声药业继SIM0505(靶向CDH6的ADC)于今年1月在中国获批IND之后,又一款ADC癌症新药获批临床。
(8)武田制药在研酶替代疗法在中国申报上市,针对血小板减少性紫癜
4月10日,中国国家药监局药品审评中心(CDE)官网最新公示,武田(Takeda)申报的注射用阿帕达酶α上市申请获得受理。公开资料显示,这是武田研发的酶替代疗法apadamtase alfa(Adzynma),已经于2023年11月获美国FDA批准,为首款获FDA所批准用于治疗先天性血栓性血小板减少性紫癜(cTTP)成人和儿童患者的酶替代疗法。该药已于今年3月被CDE正式纳入优先审评,适用于儿童和成人先天性血栓性血小板减少性紫癜(cTTP)患者的按需或预防酶替代治疗(ERT)。
(9)信念医药血友病基因疗法在中国获批上市
4月10日,中国国家药监局(NMPA)宣布通过优先审评审批程序批准信念医药全资子公司上海信致医药科技有限公司申报的波哌达可基注射液(商品名:信玖凝)上市,用于治疗中重度血友病 B(先天性凝血因子IX缺乏症)成年患者。血友病 B是由凝血因子 IX(FIX)缺乏引起的出血性疾病。波哌达可基注射液是重组腺相关病毒(rAAV)载体基因治疗产品,通过rAAV载体将FIX基因导入靶细胞(主要是肝细胞),从而表达FIX。该品种的上市为中重度血友病B成年患者提供了新的治疗选择。
(10)康方生物双抗1类新药获批临床,针对自身免疫性疾病
4月11日,中国国家药监局药品审评中心(CDE)官网最新公示,康方生物1类新药AK139注射液获批临床,拟开发治疗控制欠佳的慢性阻塞性肺疾病(COPD)、中重度控制欠佳的支气管哮喘。公开资料显示,这是康方生物研发的靶向IL-4Rα/ST2双特异性抗体,也是该公司非肿瘤领域首个进入临床阶段的双特异性抗体新药,拟针对呼吸系统及皮肤疾病等多领域疾病展开探索。康方生物此前新闻稿表示,作为IL-4Rα/ST2双抗药物,AK139可同时阻断IL-4、IL13(通过结合IL-4和IL-13受体复合物共享的IL-4Rα亚单位)和IL-33/ST2介导的炎症通路,在临床前研究中展现了优异的靶点协同效应,有望推动以上述炎症通路为主要发病机制的呼吸系统、皮肤疾病等疾病的治疗进入“双靶点时代”。
1.4.2 本周全球TOP8积极/失败临床结果
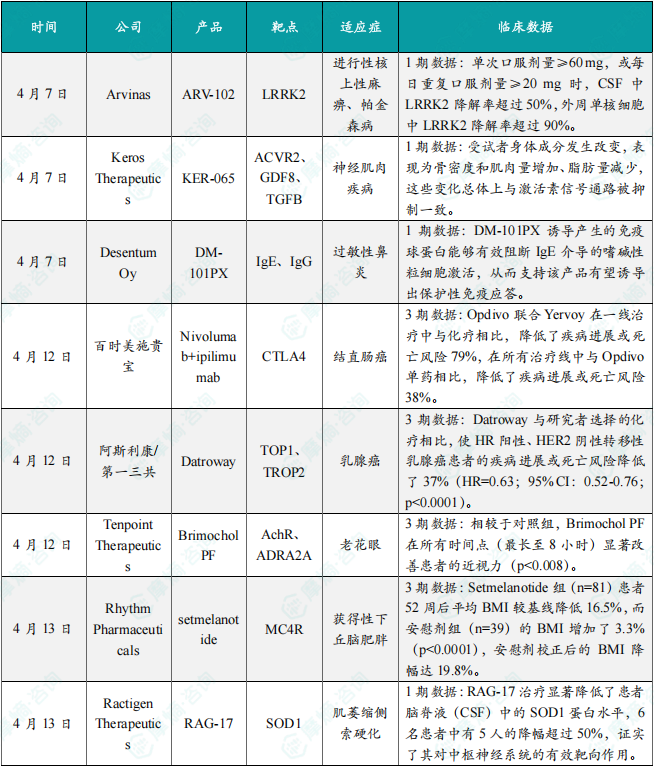
(1)Arvinas公司在研靶向蛋白降解嵌合体ARV-102 1期临床结果积极
4月7日,Arvinas公司公布了其在研靶向蛋白降解嵌合体(PROTAC)候选药物ARV-102的首次人体临床试验数据。ARV-102是一种针对富含亮氨酸重复激酶2(LRRK2)的蛋白降解剂,拟用于治疗进行性核上性麻痹、帕金森病等多种神经系统疾病。1期临床试验结果显示,ARV-102在单次或多次给药后总体安全性良好,未报告严重不良事件;ARV-102在脑脊液(CSF)中的暴露呈剂量依赖性增加,表明其具有良好的穿越血脑屏障的能力;单次口服剂量≥60 mg,或每日重复口服剂量≥20 mg时,CSF中LRRK2降解率超过50%,外周单核细胞中LRRK2降解率超过90%,表明ARV-102可实现中枢神经系统及外周LRRK2蛋白的显著降解。
(2)Keros公司杜氏肌营养不良症创新药物KER-065 1期临床试验初步顶线结果公布
4月7日,Keros Therapeutics公布了KER-065在健康志愿者中进行的1期临床试验的初步顶线结果。KER-065是一种激活素受体IIA(ActRIIA)和激活素受体IIB(ActRIIB)配体陷阱(ligand trap),被设计用于结合并抑制肌生长抑制蛋白和激活素A,从而促进骨骼肌再生、增加肌肉体积和力量、降低体脂、减少骨骼肌纤维化并增强骨骼强度。1期临床试验结果显示,KER-065总体耐受性良好,未报告严重不良事件或剂量限制性毒性;在各相关组织中均显示出对激活素抑制作用的证据,受试者身体成分发生改变,表现为骨密度和肌肉量增加、脂肪量减少,这些变化总体上与激活素信号通路被抑制一致。
(3)Desentum公司在研桦树花粉过敏疫苗DM-101PX 1期临床结果积极
4月7日,Desentum Oy公司宣布了在研桦树花粉过敏疫苗DM-101PX的积极1期临床数据。数据显示,DM-101PX的短程治疗在桦树花粉过敏患者中表现出良好的安全性和耐受性,并能诱导出非常强烈且持久的过敏原特异性IgG4应答。DM-101PX是一款用于免疫治疗桦树花粉过敏的在研疗法,其活性成分是主要桦树花粉过敏原Bet v 1的重组变体,通过基因工程改造降低了其致敏性,同时保留了所需的免疫学特性。研究发现,DM-101PX诱导产生的免疫球蛋白能够有效阻断IgE介导的嗜碱性粒细胞激活,从而支持该产品有望诱导出保护性免疫应答。
(4)百时美施贵宝重磅免疫疗法3期临床结果公布,针对结直肠癌
4月12日,百时美施贵宝(Bristol Myers Squibb)宣布,美国FDA批准Opdivo(nivolumab)联合Yervoy(ipilimumab)扩展适应症,一线治疗不可切除或转移性微卫星不稳定高(MSI-H)或错配修复缺陷(dMMR)结直肠癌(CRC)患者。该批准基于CheckMate-8HW试验,该试验评估了在各治疗线中Opdivo联合Yervoy(n=354)对比Opdivo单药治疗(n=353)以及在一线治疗中Opdivo联合Yervoy(n=202)对比研究者选择化疗(n=101)的效果。在全部治疗线中以及在一线治疗中,经盲法独立中心评审(BICR)评估,Opdivo联合Yervoy均达到了无进展生存期(PFS)的主要终点。Opdivo联合Yervoy在一线治疗中与化疗相比,降低了疾病进展或死亡风险79%,在所有治疗线中与Opdivo单药相比,降低了疾病进展或死亡风险38%。
(5)阿斯利康重磅抗体偶联药物3期临床结果公布,针对乳腺癌
4月12日,阿斯利康(AstraZeneca)和第一三共(Daiichi Sankyo)联合宣布,Datroway(datopotamab deruxtecan)已获欧盟委员会批准,用于治疗接受过内分泌治疗且在晚期至少接受过一线化疗的不可切除或转移性激素受体(HR)阳性、HER2阴性乳腺癌成年患者。欧盟委员会的批准是基于3期临床试验TROPION-Breast01的结果。经BICR评估,Datroway与研究者选择的化疗相比,使HR阳性、HER2阴性转移性乳腺癌患者的疾病进展或死亡风险降低了37%(HR=0.63;95% CI:0.52-0.76;p<0.0001)。Datroway组的中位PFS为6.9个月,而化疗组为4.9个月。Datroway组的确认客观缓解率(ORR)为36%,而化疗组为23%。Datroway组的中位缓解持续时间(DoR)为6.7个月(95% CI:5.6-9.8),化疗组为5.7个月(95% CI:4.9-6.8)。
(6)Tenpoint公司老花眼眼药水3期临床结果公布,疗效长达8小时
4月12日,Tenpoint Therapeutics宣布,该公司已向美国FDA提交了Brimochol PF滴眼液的新药申请(NDA),用于治疗老花眼。该NDA的提交得到了关键性3期临床试验BRIO-I和BRIO-II研究中积极数据的支持。近日公布的BRIO-II数据显示,相较于对照组,Brimochol PF在所有时间点(最长至8小时)显著改善患者的近视力(p<0.008)。Brimochol PF还在所有时间点显示出具有临床意义和统计学显著的瞳孔缩小效果。瞳孔缩小是缩瞳药物类别疗法的关键作用机制,通过形成针孔效应,矫正近视力丧失并增加景深。
(7)Rhythm公司黑皮质素4受体激动剂3期临床结果公布,用于治疗肥胖症
4月13日,Rhythm Pharmaceuticals公司公布了黑皮质素4受体(MC4R)激动剂setmelanotide治疗获得性下丘脑肥胖的关键3期临床试验TRANSCEND的积极顶线结果。此次公布的结果显示,该试验达到主要终点。与安慰剂相比,setmelanotide在成人和儿童患者中均实现了统计学显著且具高度临床意义的BMI降低。Setmelanotide组(n=81)患者52周后平均BMI较基线降低16.5%,而安慰剂组(n=39)的BMI增加了3.3%(p<0.0001),安慰剂校正后的BMI降幅达19.8%。此外,80%的setmelanotide治疗患者在52周时BMI降低≥5%。
(8)Ractigen公司在研siRNA疗法RAG-17 IIT试验结果公布
4月13日,中美瑞康(Ractigen Therapeutics)公布了其在研siRNA疗法RAG-17的IIT试验结果。结果显示,RAG-17通过鞘内给药表现出良好的安全性和耐受性,未报告剂量限制性毒性(DLT)或严重不良事件(SAE),大多数不良事件为轻度且短暂。RAG-17治疗显著降低了患者脑脊液(CSF)中的SOD1蛋白水平,6名患者中有5人的降幅超过50%,证实了其对中枢神经系统的有效靶向作用。血浆神经丝轻链(NfL)水平显著下降,显示RAG-17可能减缓神经退行性损伤。临床疗效信号令人鼓舞,患者ALS功能评分量表修订版(ALSFRS-R)平均下降2.17分(相当于每月下降0.29分),表明功能衰退速度可能放缓。
同期事件:
1. 2025年第15周04.07-04.13国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2025年第15周04.07-04.13国内仿制药/生物类似物申报/审批数据分析
3. 2025年第15周04.07-04.13国内医药大健康行业政策法规汇总
以上内容均来自{摩熵咨询医药行业观察周报(2025.04.07-2025.04.13)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询yl23455永利官网(原药融云)数据库(vip.sdbaichao.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!













































 浙公网安备33011002015279
浙公网安备33011002015279
 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论